Хімічнае рэчыва Хімічнае рэчыва — тып матэрыі, устойлівая сістэма часціц (атамаў, іонаў або малекул) з пэўнымі фізічнымі і хімічнымі ўласцівасцямі і саставам, які не змяняецца ў залежнасці ад пробы[1][2]. Камбінацыя некалькіх рэчываў, якія захоўваюць свае хімічныя ўласцівасці, завецца сумессю[2]. Элементы і злучэнніРэчывы падзяляюцца на элементы і злучэнні. Элементы складаюцца з атамаў аднаго тыпу (кісларод, азот, і г.д.) і не могуць быць раздзелены на больш простыя рэчывы. Злучэнні складаюцца з двух ці больш элементаў і маюць атамы розных тыпаў. Напрыклад, злучэнне вада складаецца з элементаў кіслароду і вадароду[2]. Хімічныя злучэнні могуць утварацца і распадацца ў выніку ўзаемадзеяння паміж элементамі. Напрыклад, вада ўтвараецца ў працэсе гарэння вадароду ў кіслародзе. Таксама ваду можна раздзяліць на вадарод і кісларод, калі прагнаць праз яе электрычны ток — такі працэс завецца электролізам[3]. Уласцівасці вады істотна адрозніваюцца ад уласцівасцей ізаляваных кіслароду і вадароду. Пры хатняй тэмпературы і ціску вада вадкая, тым часам як кісларод і вадарод знаходзяцца ў стане газу. У тых жа ўмовах шчыльнасць вады нашмат перавышае шчыльнасць кіслароду і вадароду. Гэта адрознівае хімічныя злучэнні ад сумесей, якія захоўваюць уласцівасці сваіх кампанентаў[4]. УласцівасціУласцівасці рэчываў падзяляюцца на хімічныя і фізічныя. Хімічныя ўласцівасці апісваюць як рэчыва можа змяняцца ў працэсе рэакцый з утварэннем іншых рэчываў. Напрыклад, хімічнай з’яўляецца ўласцівасць гаручасці — здольнасць рэчыва гарэць у прысутнасці кіслароду. Фізічныя ўласцівасці, такія як колер, пах, шчыльнасць, тэмпература плаўлення, тэмпература кіпення і цвёрдасць, могуць назірацца без пераўтварэння рэчыва ў іншыя[5]. Уласцівасці могуць быць інтэнсіўнымі — незалежнымі ад колькасці рэчыва (напрыклад, тэмпература плаўлення), або экстэнсіўнымі — залежнымі ад памеру пробы (маса, аб’ём і інш.). Інтэнсіўныя ўласцівасці могуць служыць для ідэнтыфікацыі рэчыва[5]. Агрэгатныя станыХімічныя рэчывы могуць існаваць у трох агрэгатных станах — цвёрдым, вадкім і газападобным. Так, лёд, вадкая вада і вадзяная пара — гэта цвёрды, вадкі і газападобны стан аднаго і таго ж хімічнага рэчыва — вады H2O[5]. Цвёрдыя, вадкія і газападобныя формы не з’яўляюцца індывідуальнымі характарыстыкамі хімічных рэчываў, а адпавядаюць толькі розным станам існавання хімічных рэчываў, якія залежаць ад знешніх фізічных умоў. Таму нельга прыпісваць вадзе толькі прыкметы вадкасці, кіслароду — прыкметы газу, а хларыду натрыю — прыкметы цвёрдага стану. Кожнае з гэтых (і ўсіх іншых рэчываў) пры змене ўмоў можа перайсці ў любы іншы з трох агрэгатных станаў[крыніца?]. Пры пераходзе ад ідэальных мадэлей цвёрдага, вадкага і газападобнага станаў да рэальных выяўляецца некалькі пагранічных прамежкавых тыпаў, агульнавядомымі з якіх з’яўляюцца аморфны (шклопадобны) стан, стан вадкага крышталя і высокаэластычны (палімерны) стан. У сувязі з гэтым часта карыстаюцца больш шырокім паняццем «фаза»[крыніца?]. Рэакцыі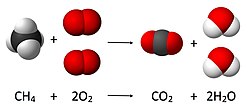 Хімічнымі рэакцыямі завуцца такія змены рэчываў, якія прыводзяць да іх пераўтварэння ў новыя, хімічна адметныя рэчывы[6]. Прыклады хімічных рэакцый:
У адрозненне ад хімічных рэакцый, фізічныя пераўтварэнні, такія як раставанне лёду, змяняюць толькі выгляд рэчыва, але не пераўтвараюць яго ў іншае рэчыва[6]. Класіфікацыя
У хіміі прынята падзяляць усе аб’екты вывучэння на індывідуальныя рэчывы (інакш — злучэнні) і іх сумесі. Пад індывідуальным рэчывам разумеюць абстрактнае паняцце, якое пазначае набор атамаў, звязаных адзін з адным па пэўнаму закону. Мяжа паміж індывідуальным рэчывам і сумессю рэчываў даволі расплыўчатая, бо існуюць рэчывы непастаяннага саставу, для якіх, наогул кажучы, нельга прапанаваць дакладнай формулы. Акрамя таго, індывідуальнае рэчыва застаецца абстракцыяй з-за таго, што практычна дасягальная толькі канечная (не 100%-ая) чысціня рэчыва. Гэта значыць, што любы канкрэтны, рэальна існуючы ўзор уяўляе сабой сумесь рэчываў, хай і з вялікай перавагай аднаго з іх. Нягледзячы на ўяўную надуманасць гэтага абмежавання, часта чысціня рэчыва іграе ключавую ролю ў яго ўласцівасцях. Так, знакамітая трываласць тытану праяўляецца толькі пасля таго, як ён ачышчаны ад кіслароду да пэўнай граніцы (менш за сотыя долі працэнта). Неарганічныя рэчывыАрганічныя рэчывы
Крыніцы
Літаратура
Спасылкі |
Portal di Ensiklopedia Dunia














