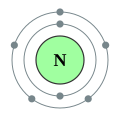
கிடைக்குழு 2 தனிமங்கள்கிடைக்குழு 2 தனிமங்கள் (Period 2 elements) தனிம அட்டவணையில் உள்ள இரண்டாவது கிடை வரிசையில் உள்ள தனிமங்களை குறிக்கிறது. இவற்றை இரண்டாவது தொடர் தனிமங்கள் என்றும் அழைக்கலாம். இத் தொடரில் அணு எண் உயர்வதற்கேற்ப அவற்றின் ஆற்றல் கூடுகள் எலக்ட்ரான்களால் ஒரு மந்தவாயு அமைப்பு வரும்வரை முறையாக நிரப்பப்படுகின்றன. 3 முதல் 10 வரை அணு எண்களைக் கொண்ட தனிமங்கள் இத்தொடரில் இடம்பெற்றுள்ளன. மேலும், இத்தொடரில் உள்ள தனிமங்களின் இயற்பியல் மற்றும் வேதியியல் பண்புகள் ஏறுவரிசையில் அமைந்துள்ள அவற்றின் அணு எண்களுக்கு ஏற்ப ஆவர்த்தன் முறையில் மாற்றமடைகின்றன. இத்தொடரில் உள்ள தனிமங்கள் அவை இடம்பெற்றுள்ள மேலிருந்து கீழாகச் செல்லும் குழுவில் உள்ள தனிமங்களுடன் ஒத்த பண்புகளைப் பெற்றுள்ளன. கிடைக்குழு 2ல் லித்தியம்(Li), பெரிலியம்(Be),போரான்(B ) ,கார்பன்(C ),நைதரசன்(N ),ஆக்சிசன்(O ) ,புளோரின்(B),நியான்(Ne) என்று எட்டு தனிமங்கள் உள்ளன. இவை அனைத்தும் எசு மற்றும் பி-வலைக்குழுவை சார்ந்த தனிமங்களாகும். இத்தொடரில் உள்ள தனிமங்களின் நிலையைக் அணுக்கட்டமைப்பு குறித்த நவீன கோட்பாடுகள் விவரிக்கின்றன. அணுக்கட்டமைப்பற்றி விவரிக்கும் குவாண்டம் இயக்கவியல் கொள்கை, 2எசு மற்றும் 2பி ஆர்பிட்டல்களில் எலக்ட்ரான்கள் நிரம்புவதுடன் இத்தொடர் தொடர்புடையது என்று கூறுகிறது. இரண்டாவது தொடரில் இடம்பெற்றுள்ள தனிமங்கள் எண்ம விதியை பின்பற்றுகின்றன. இவ்விதியின்படி இணைதிறன் கூட்டை நிரப்புவதற்கு அவற்றுக்கு எட்டு எலக்ட்ரான்கள் தேவைப்படுகின்றன. 1எசு ஆர்பிட்டலில் 2 எலக்ட்ரான்கள், 2எசு ஆர்பிட்டலில் 2 எலக்ட்ரான்கள், 2பி ஆர்பிட்டலில் 6 எலக்ட்ரான்கள் என மொத்தம் 10 எலக்ட்ரான்களுக்கு இத்தொடரில் உள்ள தனிமங்களால் இடமளிக்க முடியும். தனிமங்கள்
ஆவர்த்தனப் போக்குகள் இரண்டாவது தொடர் தனிமங்களில் இருந்துதான் தனிம வரிசை அட்டவணையின் ஆவர்த்தனப் போக்குகள் தோற்றம் கொள்கின்றன. மிகக் குறுகிய முதல் தொடரில் ஐதரசன் மற்றும் ஈலியம் என்ற இரண்டு தனிமங்கள் மட்டுமே இடம்பெற்றுள்ளதால் இவற்றிலிருந்து தீர்மானமான ஆவர்த்தனப் போக்குகள் எதையும் இறுதி செய்ய முடியவில்லை. ஏனெனில் இந்த இரண்டு தனிமங்களும் மற்ற எசு தொகுதி தனிமங்கள் எதைப்போலவும் பண்புகளை வெளிப்படுத்துவதில்லை[1][2] . இரண்டாவது தொடர் தனிமங்களில் அதிக அளவுக்கு தீர்மானமான ஆவர்த்தனப் போக்குகளை உணரமுடிகிறது. இத்தொடரில் இடம்பெற்றுள்ள அனைத்து தனிமங்களின் அணு எண்களும் அதிகரிக்கின்றன. தனிமங்களின் அணு ஆரங்கள் குறைகின்றன. மின்னெதிர் தன்மையும், அயனியாக்கும் ஆற்றலும் அதிகரிக்கின்றன[3]. இலித்தியம், பெரிலியம் என்ற இரண்டு உலோகங்கள் மட்டும் இரண்டாவது தொடரில் இடம்பெற்றுள்ளன. குறைந்த உலோகங்களைப் பெற்றுள்ள தொடர் என்ற பெயரை இத்தொடருக்கு இவ்விரு உலோகங்களும் பெற்றுத்தருகின்றன. முதல் தொடரில் உலோகங்கள் எதுவும் கிடையாது. ஆனால் அதில் இரண்டு தனிமங்கள் மட்டுமே உள்ளன. இரண்டாவது தொடரில் இடம்பெற்றுள்ள தனிமங்களின் பண்புகள் பெரும்பாலும் அவை இடம்பெற்றுள்ள குழுவில் உள்ள தனிமங்களைக் காட்டிலும் உச்சகட்ட நிலையில் காணப்படுகின்றன. உதாரணமாக புளோரின் அதிக வினைத்திறன் கொண்ட ஆலசனாகும். நியான் வாயு உச்சமான மந்தவாயுப் பண்புகளைக் கொண்டுள்ளது. அதேபோல இலித்தியம் மிகக்குறைவான வினைத்திறன் கொண்ட கார உலோகமாகும்[4] இத்தொடரிலுள்ள அனைத்துத் தனிமங்களும் மேட்லங்கு விதியைப் பின்பற்றுகின்றன. 2எசு தொடரில் இலித்தியமும், பெரிலியமும் 2எசு துணைக்கூட்டை நிரப்புகின்றன. போரான், கார்பன், நைட்ரசன், ஆக்சிசன், புளோரின் மற்றும் நியான் போன்ற பிற தனிமங்கள் 2பி துனைக்கூட்டை நிரப்புகின்றன. இவ்விசேட பண்பை முதல் மற்றும் மூன்றாம் தொடருடன் இத்தொடர் பகிர்ந்து கொள்கிறது. இவ்விதியிலிருந்து மாறுபடும் இடை நிலைத்தனிமங்கள் மற்றும் உள்ளிடைத் தனிமங்கள் எதுவும் இத்தொடரில் இடம்பெறவில்லை. இலித்தியம்இலித்தியம் Li என்ற மூலக்கூற்று வாய்ப்பாடு|மூலக்கூற்று வாய்ப்பாட்டுடன்]] வெள்ளி போலும் தோற்றம் உள்ள மென்மையான ஒரு மாழை (உலோகம்) ஆகும். இது தனிம அட்டவணையில் 3ஆவதாக உள்ள ஒரு தனிமம். இதன் அணுவெண் 3. இதன் அணுக்கருவில் மூன்று நேர்மின்னிகளும் நான்கு நொதுமிகளும் உள்ளன. இது மிகவும் மென்மையாக உள்ளதால், ஒரு கத்தியால் எளிதாக வெட்டலாம். உலோகங்கள் யாவற்றிலும் மிகக்குறைவான எடை கொண்ட உலோகம் இலித்தியம் ஆகும். இலித்தியத்தின் அடர்த்தி நீரின் அடர்த்தியில் பாதியளவு தான். இலித்தியம் மின்கலங்களில் பெருமளவு பயன்படுகின்றது. பெருவெடிப்பின் போது தோன்றிய தனிமங்களில் ஒன்றாக இலித்தியம் கருதப்படுகிறது. புவிப்பரப்பில் அதிகமாகக் கிடைக்கும் தனிமங்களின் வரிசையில் இலித்தியம் 33 ஆவது இடத்தைப் பிடிக்கிறது. அதிக வினைத்திறன் கொண்டது என்பதால் இலித்தியம் இயற்கையில் தனித்துக் கிடைப்பதில்லை. ஆனால் சேர்மங்களாகக் காணப்படுகிறது. பெரிலியம்பெரிலியம் என்பது Be என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு தனிமம் ஆகும். இதன் அணுவெண் 4. இது வெப்பத்தை நன்றாகக் கடத்தும் ஒரு தனிமம் ஆகும். செப்பு போன்ற உலோகங்களுக்கு உறுதியூட்ட சிறிதளவு பெரிலியம் சேர்க்கப்படுகின்றது. X-கதிர்கள் இவ்வுலோகத்தைக் கடந்து செல்லவல்லன. இத்தனிமம், காந்தத்தன்மை ஏதுமற்றது. நைட்டிரிக் காடியால் தாக்குண்டும் கரையாத பொருள் ஆகும். பெருவெடிப்பின் போது சிறிய அளவில் பெரிலியம் தோன்றியிருக்கலாம் எனக் கருதப்படுகிறது. பெரிலியமும் பெரிலியம் சேர்மங்களும் புற்று நோயை உண்டாக்கக் கூடியவை என்று வகைப்படுத்தப்பட்டுள்ளன. மேற்கோள்கள்
|
|||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia