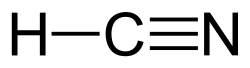–¶–∏—ò–∞–Ω–æ–≤–æ–¥–æ—Ä–æ–¥
–¶–∏—ò–∞–Ω–æ–≤–æ–¥–æ—Ä–æ–¥, –ø–æ–Ω–µ–∫–æ–≥–∞—à –Ω–∞—Ä–µ—á–µ–Ω –∏ –ø—Ä—É—Å–∏–Ω—Å–∫–∞ –∫–∏—Å–µ–ª–∏–Ω–∞ ‚Äî —Ö–µ–º–∏—Å–∫–æ —Å–æ–µ–¥–∏–Ω–µ–Ω–∏–µ —Å–æ —Ñ–æ—Ä–º—É–ª–∞ HCN –∏ —Å—Ç—Ä—É–∫—Ç—É—Ä–∞ H‚ÄìC‚â°N. –¢–æ–∞ –µ –±–µ–∑–±–æ—ò–Ω–∞, –∏—Å–∫–ª—É—á–∏—Ç–µ–ª–Ω–æ –æ—Ç—Ä–æ–≤–Ω–∞ –∏ –∑–∞–ø–∞–ª–∏–≤–∞ —Ç–µ—á–Ω–æ—Å—Ç –∫–æ—ò–∞ –≤—Ä–∏–µ –º–∞–ª–∫—É –Ω–∞–¥ —Å–æ–±–Ω–∞—Ç–∞ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∞, –Ω–∞ 25.6 ¬∞C (78.1 ¬∞F). HCN —Å–µ –ø—Ä–æ–∏–∑–≤–µ–¥—É–≤–∞ –Ω–∞ –∏–Ω–¥—É—Å—Ç—Ä–∏—Å–∫–æ –Ω–∏–≤–æ –∏ –µ –≤–∏—Å–æ–∫–æ —Ü–µ–Ω–µ—Ç –ø—Ä–µ—Ç—Ö–æ–¥–Ω–∏–∫ –Ω–∞ –º–Ω–æ–≥—É —Ö–µ–º–∏—Å–∫–∏ —Å–æ–µ–¥–∏–Ω–µ–Ω–∏—ò–∞ –∫–æ–∏ —Å–µ –¥–≤–∏–∂–∞—Ç –æ–¥ –ø–æ–ª–∏–º–µ—Ä–∏ –¥–æ —Ñ–∞—Ä–º–∞—Ü–µ–≤—Ç—Å–∫–∏ –ø—Ä–æ–∏–∑–≤–æ–¥–∏. –ü—Ä–∏–º–µ–Ω–∏—Ç–µ –æ–¥ –≥–æ–ª–µ–º–∏ —Ä–∞–∑–º–µ—Ä–∏ —Å–µ –∑–∞ –ø—Ä–æ–∏–∑–≤–æ–¥—Å—Ç–≤–æ –Ω–∞ –∫–∞–ª–∏—É–º —Ü–∏—ò–∞–Ω–∏–¥ –∏ –∞–¥–∏–ø–æ–Ω–∏—Ç—Ä–∏–ª, –∫–æ–∏ —Å–µ –∫–æ—Ä–∏—Å—Ç–∞—Ç –≤–æ —Ä—É–¥–∞—Ä—Å—Ç–≤–æ—Ç–æ –∏ –ø–ª–∞—Å—Ç–∏–∫–∞—Ç–∞, —Å–æ–æ–¥–≤–µ—Ç–Ω–æ.[8] –¢–æ—ò –µ –ø–æ–æ—Ç—Ä–æ–≤–µ–Ω –æ–¥ —Ü–≤—Ä—Å—Ç–∏—Ç–µ —Å–æ–µ–¥–∏–Ω–µ–Ω–∏—ò–∞ –Ω–∞ —Ü–∏—ò–∞–Ω–∏–¥ –ø–æ—Ä–∞–¥–∏ –Ω–µ–≥–æ–≤–∞—Ç–∞ –∏—Å–ø–∞—Ä–ª–∏–≤–∞ –ø—Ä–∏—Ä–æ–¥–∞. –°—Ç—Ä—É–∫—Ç—É—Ä–∞ –∏ –æ–ø—à—Ç–∏ —Å–≤–æ—ò—Å—Ç–≤–∞–¶–∏—ò–∞–Ω–æ–≤–æ–¥–æ—Ä–æ–¥–æ—Ç –µ –ª–∏–Ω–µ–∞—Ä–Ω–∞ –º–æ–ª–µ–∫—É–ª–∞, —Å–æ —Ç—Ä–æ—ò–Ω–∞ –≤—Ä—Å–∫–∞ –ø–æ–º–µ—ì—É —ò–∞–≥–ª–µ—Ä–æ–¥–æ—Ç –∏ –∞–∑–æ—Ç. –¢–∞–≤—Ç–æ–º–µ—Ä–æ—Ç –Ω–∞ HCN –µ HNC, –≤–æ–¥–æ—Ä–æ–¥–µ–Ω –∏–∑–æ—Ü–∏—ò–∞–Ω–∏–¥. –¶–∏—ò–∞–Ω–æ–≤–æ–¥–æ—Ä–æ–¥–æ—Ç –µ —Å–ª–∞–±–æ –∫–∏—Å–µ–ª —Å–æ pKa –æ–¥ 9,2. –î–µ–ª—É–º–Ω–æ —Å–µ —ò–æ–Ω–∏–∑–∏—Ä–∞ –≤–æ –≤–æ–¥–µ–Ω —Ä–∞—Å—Ç–≤–æ—Ä –∑–∞ –¥–∞ —Å–µ –¥–æ–±–∏–µ –∞–Ω—ò–æ–Ω –Ω–∞ —Ü–∏—ò–∞–Ω–∏–¥, CN -. –Ý–∞—Å—Ç–≤–æ—Ä–æ—Ç –Ω–∞ —Ü–∏—ò–∞–Ω–æ–≤–æ–¥–æ—Ä–æ–¥ –≤–æ –≤–æ–¥–∞, –ø—Ä–µ—Ç—Å—Ç–∞–≤–µ–Ω –∫–∞–∫–æ HCN, —Å–µ –Ω–∞—Ä–µ–∫—É–≤–∞ —Ü–∏—ò–∞–Ω–æ–≤–æ–¥–æ—Ä–æ–¥–Ω–∞ –∫–∏—Å–µ–ª–∏–Ω–∞. –°–æ–ª–∏—Ç–µ –Ω–∞ —Ü–∏—ò–∞–Ω–∏–¥–Ω–∏–æ—Ç –∞–Ω—ò–æ–Ω —Å–µ –ø–æ–∑–Ω–∞—Ç–∏ –∫–∞–∫–æ —Ü–∏—ò–∞–Ω–∏–¥–∏. HCN –∏–º–∞ —Å–ª–∞–± –º–∏—Ä–∏—Å –Ω–∞ –≥–æ—Ä—á–ª–∏–≤ –±–∞–¥–µ–º –∫–æ—ò –Ω–µ–∫–æ–∏ –ª—É—ì–µ –Ω–µ –º–æ–∂–∞—Ç –¥–∞ –≥–æ –¥–µ—Ç–µ–∫—Ç–∏—Ä–∞–∞—Ç –ø–æ—Ä–∞–¥–∏ —Ä–µ—Ü–µ—Å–∏–≤–Ω–∞ –≥–µ–Ω–µ—Ç—Å–∫–∞ –æ–¥–ª–∏–∫–∞.[9] –ò—Å–ø–∞—Ä–ª–∏–≤–æ—Ç–æ —Å–æ–µ–¥–∏–Ω–µ–Ω–∏–µ —Å–µ –∫–æ—Ä–∏—Å—Ç–µ–ª–æ –∫–∞–∫–æ –≥–ª–æ–¥–∞—Ä–∏—Ü–∏–¥ –∑–∞ –≤–¥–∏—à—É–≤–∞—ö–µ –∏ —á–æ–≤–µ—á–∫–∏ –æ—Ç—Ä–æ–≤, –∫–∞–∫–æ –∏ –∑–∞ —É–±–∏–≤–∞—ö–µ –Ω–∞ –∫–∏—Ç–æ–≤–∏.[10] –¶–∏—ò–∞–Ω–∏–¥–Ω–∏—Ç–µ —ò–æ–Ω–∏ –∏–Ω—Ç–µ—Ä—Ñ–µ—Ä–∏—Ä–∞–∞—Ç —Å–æ —Ä–µ—Å–ø–∏—Ä–∞—Ç–æ—Ä–Ω–∏—Ç–µ –µ–Ω–∑–∏–º–∏ —à—Ç–æ —Å–æ–¥—Ä–∂–∞—Ç –∂–µ–ª–µ–∑–æ. –•–µ–º–∏—Å–∫–∏ —Å–≤–æ—ò—Å—Ç–≤–∞–¶–∏—ò–∞–Ω–æ–≤–æ–¥–æ—Ä–æ–¥ —ú–µ —Ä–µ–∞–≥–∏—Ä–∞ —Å–æ –∞–ª–∫–µ–Ω–∏ –ø—Ä–∏ –∫–∞—Ç–∞–ª–∏–∑–∞ –Ω–∞ –Ω–∏–∫–µ–ª –∫–æ–º–ø–ª–µ–∫—Å–∏. –û–≤–∞–∞ —Ä–µ–∞–∫—Ü–∏—ò–∞ —Å–µ –Ω–∞—Ä–µ–∫—É–≤–∞ —Ö–∏–¥—Ä–æ—Ü–∏—ò–∞–Ω–∏–∑–∞—Ü–∏—ò–∞.[11]
–ß–µ—Ç–∏—Ä–∏ –º–æ–ª–µ–∫—É–ª–∏ –Ω–∞ HCN —ú–µ —Å–µ —Ç–µ—Ç—Ä–∞–º–µ—Ä–∏–∑–∏—Ä–∞–∞—Ç –≤–æ –¥–∏–∞–º–∏–Ω–æ–º–∞–ª–µ–æ–Ω–∏—Ç—Ä–∏–ª, –∫–æ—ò –º–æ–∂–µ –¥–∞ —Å–µ –ø—Ä–µ—Ç–≤–æ—Ä–∏ –≤–æ —Ä–∞–∑–ª–∏—á–Ω–∏ –ø—É—Ä–∏–Ω–∏.[12] –ò—Å—Ç–æ—Ä–∏—ò–∞ –Ω–∞ –æ—Ç–∫—Ä–∏–≤–∞—ö–µ –¶–∏—ò–∞–Ω–æ–≤–æ–¥–æ—Ä–æ–¥–æ—Ç –ø—Ä–≤–ø–∞—Ç –±–∏–ª –∏–∑–æ–ª–∏—Ä–∞–Ω –æ–¥ —Å–∏–Ω–∏–æ—Ç –ø–∏–≥–º–µ–Ω—Ç (–ø—Ä—É—Å–∫–æ —Å–∏–Ω–æ) –∫–æ—ò –±–∏–ª –ø–æ–∑–Ω–∞—Ç —É—à—Ç–µ –æ–¥ 1706 –≥–æ–¥–∏–Ω–∞, –Ω–æ —á–∏—ò–∞ —Å—Ç—Ä—É–∫—Ç—É—Ä–∞ –±–∏–ª–∞ –Ω–µ–ø–æ–∑–Ω–∞—Ç–∞. –°–µ–≥–∞ –µ –ø–æ–∑–Ω–∞—Ç–æ –¥–µ–∫–∞ –µ –∫–æ–æ—Ä–¥–∏–Ω–∞—Ç–∏–≤–µ–Ω –ø–æ–ª–∏–º–µ—Ä —Å–æ —Å–ª–æ–∂–µ–Ω–∞ —Å—Ç—Ä—É–∫—Ç—É—Ä–∞ –∏ –µ–º–ø–∏—Ä–∏—Å–∫–∞ —Ñ–æ—Ä–º—É–ª–∞ –Ω–∞ —Ö–∏–¥—Ä–∏—Ä–∞–Ω –∂–µ–ª–µ–∑–µ–Ω —Ñ–µ—Ä–æ—Ü–∏—ò–∞–Ω–∏–¥. –í–æ 1752 –≥–æ–¥–∏–Ω–∞, —Ñ—Ä–∞–Ω—Ü—É—Å–∫–∏–æ—Ç —Ö–µ–º–∏—á–∞—Ä –ü—ò–µ—Ä –ú–∞–∫–µ—Ä –Ω–∞–ø—Ä–∞–≤–∏–ª –≤–∞–∂–µ–Ω —á–µ–∫–æ—Ä –∑–∞ –¥–∞ –ø–æ–∫–∞–∂–µ –¥–µ–∫–∞ –ø—Ä—É—Å–∫–∞—Ç–∞ —Å–∏–Ω–∞ –±–æ—ò–∞ –º–æ–∂–µ –¥–∞ —Å–µ –ø—Ä–µ—Ç–≤–æ—Ä–∏ –≤–æ –∂–µ–ª–µ–∑–µ–Ω –æ–∫—Å–∏–¥ –ø–ª—É—Å –∏—Å–ø–∞—Ä–ª–∏–≤–∞ –∫–æ–º–ø–æ–Ω–µ–Ω—Ç–∞ –∏ –¥–µ–∫–∞ —Ç–∏–µ –º–æ–∂–µ –¥–∞ —Å–µ –∏—Å–∫–æ—Ä–∏—Å—Ç–∞—Ç –∑–∞ –Ω–µ—ò–∑–∏–Ω–æ —Ä–µ–∫–æ–Ω—Å—Ç–∏—Ç—É–∏—Ä–∞—ö–µ.[13] –ù–æ–≤–∞—Ç–∞ –∫–æ–º–ø–æ–Ω–µ–Ω—Ç–∞ –±–∏–ª–∞ –æ–Ω–∞ —à—Ç–æ —Å–µ–≥–∞ –µ –ø–æ–∑–Ω–∞—Ç–æ –∫–∞–∫–æ —Ü–∏—ò–∞–Ω–æ–≤–æ–¥–æ—Ä–æ–¥. –°–ª–µ–¥–µ—ò—ú–∏ –≥–æ –≤–æ–¥—Å—Ç–≤–æ—Ç–æ –Ω–∞ –ú–∞–∫–µ—Ä, —Ç–æ—ò –ø—Ä–≤–ø–∞—Ç –±–∏–ª –ø–æ–¥–≥–æ—Ç–≤–µ–Ω –æ–¥ –ø—Ä—É—Å–∫–æ —Å–∏–Ω–æ –æ–¥ —à–≤–µ–¥—Å–∫–∏–æ—Ç —Ö–µ–º–∏—á–∞—Ä –ö–∞—Ä–ª –í–∏–ª—Ö–µ–ª–º –®–µ–ª–µ –≤–æ 1782 –≥–æ–¥–∏–Ω–∞,[14] –∏ –Ω–∞ –∫—Ä–∞—ò–æ—Ç –≥–æ –¥–æ–±–∏–ª –≥–µ—Ä–º–∞–Ω—Å–∫–æ—Ç–æ –∏–º–µ Blaus√§ure (—Å–≤–µ—Ç–ª–æ ‚Äû–°–∏–Ω–∞ –∫–∏—Å–µ–ª–∏–Ω–∞‚Äú) –ø–æ—Ä–∞–¥–∏ –Ω–µ–≥–æ–≤–∞—Ç–∞ –∫–∏—Å–µ–ª–∞ –ø—Ä–∏—Ä–æ–¥–∞ –≤–æ –≤–æ–¥–∞—Ç–∞ –∏ –¥–µ—Ä–∏–≤–∏—Ä–∞—ö–µ –æ–¥ –ø—Ä—É—Å–∫–∞—Ç–∞ —Å–∏–Ω–∞ –±–æ—ò–∞. –ù–∞ –∞–Ω–≥–ª–∏—Å–∫–∏, –ø–æ–ø—É–ª–∞—Ä–Ω–æ —Å—Ç–∞–Ω–∞–ª–∞ –ø–æ–∑–Ω–∞—Ç–∞ –∫–∞–∫–æ –ø—Ä—É—Å–∏–Ω—Å–∫–∞ –∫–∏—Å–µ–ª–∏–Ω–∞. –í–æ 1787 –≥–æ–¥–∏–Ω–∞, —Ñ—Ä–∞–Ω—Ü—É—Å–∫–∏–æ—Ç —Ö–µ–º–∏—á–∞—Ä –ö–ª–æ–¥ –õ—É—ò –ë–µ—Ä—Ç–æ–ª–µ –ø–æ–∫–∞–∂–∞–ª –¥–µ–∫–∞ –ø—Ä—É—Å–∏–Ω—Å–∫–∞—Ç–∞ –∫–∏—Å–µ–ª–∏–Ω–∞ –Ω–µ —Å–æ–¥—Ä–∂–∏ –∫–∏—Å–ª–æ—Ä–æ–¥,[15] –≤–∞–∂–µ–Ω –ø—Ä–∏–¥–æ–Ω–µ—Å –≤–æ —Ç–µ–æ—Ä–∏—ò–∞—Ç–∞ –Ω–∞ –∫–∏—Å–µ–ª–∏–Ω–∞, –∫–æ—ò–∞ –¥–æ —Ç–æ–∞ –≤—Ä–µ–º–µ —Å–µ –ø—Ä–µ—Ç–ø–æ—Å—Ç–∞–≤—É–≤–∞–ª–æ –¥–µ–∫–∞ –∫–∏—Å–µ–ª–∏–Ω–∏—Ç–µ –º–æ—Ä–∞ –¥–∞ —Å–æ–¥—Ä–∂–∞—Ç –∫–∏—Å–ª–æ—Ä–æ–¥ [16] (–æ—Ç—Ç—É–∫–∞ –∏ –∏–º–µ—Ç–æ –Ω–∞ —Å–∞–º–∏–æ—Ç –∫–∏—Å–ª–æ—Ä–æ–¥, —à—Ç–æ –µ –¥–æ–±–∏–µ–Ω–∏ –æ–¥ –≥—Ä—á–∫–∏ –µ–ª–µ–º–µ–Ω—Ç–∏ —à—Ç–æ –∑–Ω–∞—á–∞—Ç ‚Äû—Å–æ–∑–¥–∞–≤–∞—á –Ω–∞ –∫–∏—Å–µ–ª–∏–Ω–∞‚Äú –∏ –∏—Å—Ç–æ —Ç–∞–∫–∞ —Å–µ –ø—Ä–µ—Å–º–µ—Ç—É–≤–∞–∞—Ç –Ω–∞ –≥–µ—Ä–º–∞–Ω—Å–∫–∏ –∫–∞–∫–æ Sauerstoff ). –í–æ 1811 –≥–æ–¥–∏–Ω–∞, –è–æ–∑–µ—Ñ –õ—É–∏—Å –ì–µ—ò-–õ–∏—Å–∞–∫ –ø–æ–¥–≥–æ—Ç–≤–∏ —á–∏—Å—Ç, —Ç–µ—á–µ–Ω —Ü–∏—ò–∞–Ω–æ–≤–æ–¥–æ—Ä–æ–¥.[17] –í–æ 1815 –≥., –ì–µ—ò-–õ—É—Å–∏–∫ —ò–∞ –∑–∞–∫–ª—É—á–∏–ª —Ö–µ–º–∏—Å–∫–∞—Ç–∞ —Ñ–æ—Ä–º—É–ª–∞ –Ω–∞ –ø—Ä—É—Å–∫–∞ –∫–∏—Å–µ–ª–∏–Ω–∞.[18] –Ý–∞–¥–∏–∫–∞–ª–Ω–∏–æ—Ç —Ü–∏—ò–∞–Ω–∏–¥ –≤–æ —Ü–∏—ò–∞–Ω–æ–≤–æ–¥–æ—Ä–æ–¥ –≥–æ –¥–æ–±–∏–ª —Å–≤–æ–µ—Ç–æ –∏–º–µ –æ–¥ —Ü–∏—ò–∞–Ω, –Ω–µ —Å–∞–º–æ –∞–Ω–≥–ª–∏—Å–∫–∏ –∑–±–æ—Ä –∑–∞ –Ω–∏—ò–∞–Ω—Å–∞ –Ω–∞ —Å–∏–Ω–æ —Ç—É–∫—É –≥—Ä—á–∫–∏ –∑–±–æ—Ä –∑–∞ —Å–∏–Ω–æ (—Å—Ç–∞—Ä–æ–≥—Ä—á–∫–∏: Œ∫œçŒ±ŒΩŒøœÇ), –ø–æ–≤—Ç–æ—Ä–Ω–æ –ø–æ—Ä–∞–¥–∏ –Ω–µ–≥–æ–≤–æ—Ç–æ –¥–µ—Ä–∏–≤–∏—Ä–∞—ö–µ –æ–¥ –ø—Ä—É—Å–∫–∞—Ç–∞ —Å–∏–Ω–∞ –±–æ—ò–∞. –ü—Ä–æ–∏–∑–≤–æ–¥—Å—Ç–≤–æ –∏ —Å–∏–Ω—Ç–µ–∑–∞–¶–∏—ò–∞–Ω–æ–≤–æ–¥–æ—Ä–æ–¥–æ—Ç —Å–µ —Ñ–æ—Ä–º–∏—Ä–∞ –≤–æ –±–∞—Ä–µ–º –æ–≥—Ä–∞–Ω–∏—á–µ–Ω–∏ –∫–æ–ª–∏—á–∏–Ω–∏ –æ–¥ –º–Ω–æ–≥—É –∫–æ–º–±–∏–Ω–∞—Ü–∏–∏ –Ω–∞ –≤–æ–¥–æ—Ä–æ–¥, —ò–∞–≥–ª–µ—Ä–æ–¥ –∏ –∞–º–æ–Ω–∏—ò–∞–∫. –¶–∏—ò–∞–Ω–æ–≤–æ–¥–æ—Ä–æ–¥–æ—Ç –≤–æ –º–æ–º–µ–Ω—Ç–æ–≤ —Å–µ –ø—Ä–æ–∏–∑–≤–µ–¥—É–≤–∞ –≤–æ –≥–æ–ª–µ–º–∏ –∫–æ–ª–∏—á–∏–Ω–∏ —Å–æ –Ω–µ–∫–æ–ª–∫—É –ø—Ä–æ—Ü–µ—Å–∏, –∫–∞–∫–æ –∏ –æ–±–Ω–æ–≤–µ–Ω –æ—Ç–ø–∞–¥–µ–Ω –ø—Ä–æ–∏–∑–≤–æ–¥ –æ–¥ –ø—Ä–æ–∏–∑–≤–æ–¥—Å—Ç–≤–æ—Ç–æ –Ω–∞ –∞–∫—Ä–∏–ª–æ–Ω–∏—Ç—Ä–∏–ª.[8] –í–æ 2006 –≥–æ–¥–∏–Ω–∞, –≤–æ –°–ê–î –±–∏–ª–µ –ø—Ä–æ–∏–∑–≤–µ–¥–µ–Ω–∏ –ø–æ–º–µ—ì—É 500 –º–∏–ª–∏–æ–Ω–∏ –∏ 1 –º–∏–ª–∏—ò–∞—Ä–¥–∏ (–ø–æ–º–µ—ì—É 230.000 –∏ 450.000 t).[19] –ù–∞—ò–≤–∞–∂–Ω–∏–æ—Ç –ø—Ä–æ—Ü–µ—Å –µ –ê–Ω–¥—Ä—É—Å–æ–≤–∞—Ç–∞ –æ–∫—Å–∏–¥–∞—Ü–∏—ò–∞ –∏–∑–º–∏—Å–ª–µ–Ω–∞ –æ–¥ –õ–µ–æ–Ω–∏–¥ –ê–Ω–¥—Ä—É—Å–æ–≤ –≤–æ –ò–ì –§–∞—Ä–±–µ–Ω –≤–æ –∫–æ—ò–∞ –º–µ—Ç–∞–Ω–æ—Ç –∏ –∞–º–æ–Ω–∏—ò–∞–∫–æ—Ç —Ä–µ–∞–≥–∏—Ä–∞–∞—Ç –≤–æ –ø—Ä–∏—Å—É—Å—Ç–≤–æ –Ω–∞ –∫–∏—Å–ª–æ—Ä–æ–¥ –Ω–∞ –æ–∫–æ–ª—É 1,200 ¬∞C (2.190 ¬∞F) –Ω–∞–¥ –ø–ª–∞—Ç–∏–Ω–∞ –∫–∞—Ç–∞–ª–∏–∑–∞—Ç–æ—Ä:[20]
–ï–Ω–µ—Ä–≥–∏—ò–∞—Ç–∞ –ø–æ—Ç—Ä–µ–±–Ω–∞ –∑–∞ —Ä–µ–∞–∫—Ü–∏—ò–∞—Ç–∞ —Å–µ –æ–±–µ–∑–±–µ–¥—É–≤–∞ —Å–æ –¥–µ–ª—É–º–Ω–∞ –æ–∫—Å–∏–¥–∞—Ü–∏—ò–∞ –Ω–∞ –º–µ—Ç–∞–Ω–æ—Ç –∏ –∞–º–æ–Ω–∏—ò–∞–∫–æ—Ç. –û–¥ –ø–æ–º–∞–ª–∞ –≤–∞–∂–Ω–æ—Å—Ç –µ –ø—Ä–æ—Ü–µ—Å–æ—Ç –î–µ–≥—É—Å–∞ (–ë–ú–ê –ø—Ä–æ—Ü–µ—Å) –≤–æ –∫–æ—ò –Ω–µ —Å–µ –¥–æ–¥–∞–≤–∞ –∫–∏—Å–ª–æ—Ä–æ–¥ –∏ –µ–Ω–µ—Ä–≥–∏—ò–∞—Ç–∞ –º–æ—Ä–∞ –∏–Ω–¥–∏—Ä–µ–∫—Ç–Ω–æ –¥–∞ —Å–µ –ø—Ä–µ–Ω–µ—Å–µ –ø—Ä–µ–∫—É —ï–∏–¥–æ—Ç –Ω–∞ —Ä–µ–∞–∫—Ç–æ—Ä–æ—Ç:[21]
–û–≤–∞–∞ —Ä–µ–∞–∫—Ü–∏—ò–∞ –µ —Å–ª–∏—á–Ω–∞ –Ω–∞ —Ä–µ—Ñ–æ—Ä–º–∏—Ä–∞—ö–µ—Ç–æ –Ω–∞ –ø–∞—Ä–µ–∞, —Ä–µ–∞–∫—Ü–∏—ò–∞—Ç–∞ –Ω–∞ –º–µ—Ç–∞–Ω–æ—Ç –∏ –≤–æ–¥–∞—Ç–∞ –∑–∞ –¥–∞–≤–∞—ö–µ —ò–∞–≥–ª–µ—Ä–æ–¥ –º–æ–Ω–æ–∫—Å–∏–¥ –∏ –≤–æ–¥–æ—Ä–æ–¥. –í–æ –®–∞–≤–∏–Ω–∏–≥–µ–Ω—Å–∫–∏–æ—Ç –ø—Ä–æ—Ü–µ—Å, —ò–∞–≥–ª–µ–≤–æ–¥–æ—Ä–æ–¥–∏—Ç–µ, –Ω–∞ –ø—Ä. –ø—Ä–æ–ø–∞–Ω–æ—Ç, —Å–µ —Ä–µ–∞–≥–∏—Ä–∞–∞—Ç —Å–æ –∞–º–æ–Ω–∏—ò–∞–∫. –í–æ –ª–∞–±–æ—Ä–∞—Ç–æ—Ä–∏—ò–∞, –º–∞–ª–∏ –∫–æ–ª–∏—á–∏–Ω–∏ –Ω–∞ HCN —Å–µ –ø—Ä–æ–∏–∑–≤–µ–¥—É–≤–∞–∞—Ç —Å–æ –¥–æ–¥–∞–≤–∞—ö–µ –Ω–∞ –∫–∏—Å–µ–ª–∏–Ω–∏ –≤–æ —Ü–∏—ò–∞–Ω–∏–¥–Ω–∏—Ç–µ —Å–æ–ª–∏ –Ω–∞ –∞–ª–∫–∞–ª–Ω–∏—Ç–µ –º–µ—Ç–∞–ª–∏:
–û–≤–∞–∞ —Ä–µ–∞–∫—Ü–∏—ò–∞ –ø–æ–Ω–µ–∫–æ–≥–∞—à –µ –æ—Å–Ω–æ–≤–∞ –∑–∞ —Å–ª—É—á–∞—ò–Ω–∏ —Ç—Ä—É–µ—ö–∞ –±–∏–¥–µ—ò—ú–∏ –∫–∏—Å–µ–ª–∏–Ω–∞—Ç–∞ –∫–æ–Ω–≤–µ—Ä—Ç–∏—Ä–∞ –Ω–µ–∏—Å–ø–∞—Ä–ª–∏–≤–∞ —Ü–∏—ò–∞–Ω–∏–¥–Ω–∞ —Å–æ–ª –≤–æ –≥–∞—Å–æ–≤–∏—Ç–∞ HCN. –ò—Å—Ç–æ—Ä–∏—Å–∫–∏ –º–µ—Ç–æ–¥–∏ –Ω–∞ –ø—Ä–æ–∏–∑–≤–æ–¥—Å—Ç–≤–æ–ì–æ–ª–µ–º–∞—Ç–∞ –ø–æ–±–∞—Ä—É–≤–∞—á–∫–∞ –∑–∞ —Ü–∏—ò–∞–Ω–∏–¥–∏ –∑–∞ —Ä—É–¥–∞—Ä—Å–∫–∏ –æ–ø–µ—Ä–∞—Ü–∏–∏ –≤–æ 1890-—Ç–∏—Ç–µ –±–∏–ª–∞ –∏—Å–ø–æ–ª–Ω–µ—Ç–∞ –æ–¥ –è–æ—Ä—ü –¢–æ–º–∞—Å –ë–µ—ò–ª–±–∏, –∫–æ—ò –ø–∞—Ç–µ–Ω—Ç–∏—Ä–∞–ª –º–µ—Ç–æ–¥ –∑–∞ –ø—Ä–æ–∏–∑–≤–æ–¥—Å—Ç–≤–æ –Ω–∞ —Ü–∏—ò–∞–Ω–æ–≤–æ–¥–æ—Ä–æ–¥ —Å–æ –ø–æ–º–∏–Ω—É–≤–∞—ö–µ –Ω–∞ –∞–º–æ–Ω–∏—ò–∞–∫ –ø—Ä–µ–∫—É –±–ª–µ—Å–∫–∞–≤ —ò–∞–≥–ª–µ–Ω –≤–æ 1892 –≥–æ–¥–∏–Ω–∞. –û–≤–æ—ò –º–µ—Ç–æ–¥ —Å–µ –∫–æ—Ä–∏—Å—Ç–µ–ª –¥–æ–¥–µ–∫–∞ –•–∞–º–∏–ª—Ç–æ–Ω –ö–∞—Å—Ç–Ω–µ—Ä –≤–æ 1894 –≥–æ–¥–∏–Ω–∞ –Ω–µ —Ä–∞–∑–≤–∏–ª —Å–∏–Ω—Ç–µ–∑–∞ –ø–æ—á–Ω—É–≤–∞—ò—ú–∏ –æ–¥ —ò–∞–≥–ª–µ–Ω, –∞–º–æ–Ω–∏—ò–∞–∫ –∏ –Ω–∞—Ç—Ä–∏—É–º —à—Ç–æ –¥–∞–≤–∞ –Ω–∞—Ç—Ä–∏—É–º —Ü–∏—ò–∞–Ω–∏–¥, –∫–æ—ò —Ä–µ–∞–≥–∏—Ä–∞ —Å–æ –∫–∏—Å–µ–ª–∏–Ω–∞ –∑–∞ –¥–∞ —Ñ–æ—Ä–º–∏—Ä–∞ –≥–∞—Å–æ–≤–∏—Ç HCN. –ê–ø–ª–∏–∫–∞—Ü–∏–∏HCN –µ –ø—Ä–µ—Ç—Ö–æ–¥–Ω–∏–∫ –Ω–∞ –Ω–∞—Ç—Ä–∏—É–º —Ü–∏—ò–∞–Ω–∏–¥ –∏ –∫–∞–ª–∏—É–º —Ü–∏—ò–∞–Ω–∏–¥, –∫–æ–∏ —Å–µ –∫–æ—Ä–∏—Å—Ç–∞—Ç –≥–ª–∞–≤–Ω–æ –≤–æ –∏—Å–∫–æ–ø—É–≤–∞—ö–µ—Ç–æ –∑–ª–∞—Ç–æ –∏ —Å—Ä–µ–±—Ä–æ –∏ –∑–∞ –≥–∞–ª–≤–∞–Ω–∏–∑–∞—Ü–∏—ò–∞ –Ω–∞ —Ç–∏–µ –º–µ—Ç–∞–ª–∏. –ü—Ä–µ–∫—É –ø–æ—Å—Ä–µ–¥—Å—Ç–≤–æ –Ω–∞ —Ü–∏—ò–∞–Ω–æ—Ö–∏–¥—Ä–∏–Ω–∏—Ç–µ, —Ä–∞–∑–ª–∏—á–Ω–∏ –∫–æ—Ä–∏—Å–Ω–∏ –æ—Ä–≥–∞–Ω—Å–∫–∏ —Å–æ–µ–¥–∏–Ω–µ–Ω–∏—ò–∞ —Å–µ –ø–æ–¥–≥–æ—Ç–≤—É–≤–∞–∞—Ç –æ–¥ HCN –≤–∫–ª—É—á—É–≤–∞—ò—ú–∏ –≥–æ –º–æ–Ω–æ–º–µ—Ä–æ—Ç –º–µ—Ç–∏–ª –º–µ—Ç–∞–∫—Ä–∏–ª–∞—Ç, –æ–¥ –∞—Ü–µ—Ç–æ–Ω, –∞–º–∏–Ω–æ–∫–∏—Å–µ–ª–∏–Ω–∞—Ç–∞ –º–µ—Ç–∏–æ–Ω–∏–Ω, –ø—Ä–µ–∫—É —Å–∏–Ω—Ç–µ–∑–∞—Ç–∞ –Ω–∞ Strecker –∏ —Ö–µ–ª–∞—Ç–Ω–∏ –∞–≥–µ–Ω—Å–∏ EDTA –∏ NTA. –ü—Ä–µ–∫—É –ø—Ä–æ—Ü–µ—Å–æ—Ç –Ω–∞ —Ö–∏–¥—Ä–æ—Ü–∏—ò–∞—Ü–∏—ò–∞, HCN —Å–µ –¥–æ–¥–∞–≤–∞ –≤–æ –±—É—Ç–∞–¥–∏–µ–Ω –∑–∞ –¥–∞ —Å–µ –¥–æ–±–∏–µ –∞–¥–∏–ø–æ–Ω–∏—Ç—Ä–∏–ª, –ø—Ä–µ—Ç—Ö–æ–¥–Ω–∏–∫ –Ω–∞ –Ω–∞—ò–ª–æ–Ω-6,6.[8] HCN —Å–µ –∫–æ—Ä–∏—Å—Ç–∏ –Ω–∞ –≥–ª–æ–±–∞–ª–Ω–æ –Ω–∏–≤–æ –∫–∞–∫–æ —Ñ—É–º–∏–≥–∞–Ω—Ç –ø—Ä–æ—Ç–∏–≤ –º–Ω–æ–≥—É –≤–∏–¥–æ–≤–∏ –∏–Ω—Å–µ–∫—Ç–∏ —à—Ç–µ—Ç–Ω–∏—Ü–∏ –∫–æ–∏ –≥–∏ –Ω–∞–ø–∞—ì–∞–∞—Ç –∫–∞–ø–∞—Ü–∏—Ç–µ—Ç–∏—Ç–µ –∑–∞ –ø—Ä–æ–∏–∑–≤–æ–¥—Å—Ç–≤–æ –Ω–∞ —Ö—Ä–∞–Ω–∞. –ò –Ω–µ–≥–æ–≤–∞—Ç–∞ –µ—Ñ–∏–∫–∞—Å–Ω–æ—Å—Ç –∏ –Ω–∞—á–∏–Ω–æ—Ç –Ω–∞ –ø—Ä–∏–º–µ–Ω–∞ –¥–æ–≤–µ–¥—É–≤–∞–∞—Ç –¥–æ —É–ø–æ—Ç—Ä–µ–±–∞ –Ω–∞ –º–Ω–æ–≥—É –º–∞–ª–∏ –∫–æ–ª–∏—á–∏–Ω–∏ –Ω–∞ —Ñ—É–º–∏–≥–∞–Ω—Ç –≤–æ —Å–ø–æ—Ä–µ–¥–±–∞ —Å–æ –¥—Ä—É–≥–∏—Ç–µ —Ç–æ–∫—Å–∏—á–Ω–∏ —Å—É–ø—Å—Ç–∞–Ω—Ü–∏–∏ —à—Ç–æ —Å–µ –∫–æ—Ä–∏—Å—Ç–∞—Ç –∑–∞ –∏—Å—Ç–∞—Ç–∞ –Ω–∞–º–µ–Ω–∞.[22] –ö–æ—Ä–∏—Å—Ç–µ—ö–µ—Ç–æ –Ω–∞ HCN –∫–∞–∫–æ —Ñ—É–º–∏–≥–∞–Ω—Ç, –∏—Å—Ç–æ —Ç–∞–∫–∞, –∏–º–∞ –º–∏–Ω–∏–º–∞–ª–Ω–æ –≤–ª–∏—ò–∞–Ω–∏–µ –≤—Ä–∑ –∂–∏–≤–æ—Ç–Ω–∞—Ç–∞ —Å—Ä–µ–¥–∏–Ω–∞, –≤–æ —Å–ø–æ—Ä–µ–¥–±–∞ —Å–æ —Å–ª–∏—á–Ω–∏ —Å—Ç—Ä—É–∫—Ç—É—Ä–Ω–∏ —Ñ—É–º–∏–≥–∞–Ω—Ç–Ω–∏ –º–æ–ª–µ–∫—É–ª–∏ –∫–∞–∫–æ —à—Ç–æ —Å–µ —Å—É–ª—Ñ—É—Ä–∏–ª —Ñ–ª—É–æ—Ä–∏–¥,[23] –∏ –º–µ—Ç–∏–ª –±—Ä–æ–º–∏–¥.[24] –ü–æ—ò–∞–≤–∞HCN —Å–µ –¥–æ–±–∏–≤–∞ –æ–¥ –æ–≤–æ—à—ò–µ —à—Ç–æ –∏–º–∞ —ò–∞–º–∫–∞, –∫–∞–∫–æ —à—Ç–æ —Å–µ —Ü—Ä–µ—à–∏, –∫–∞—ò—Å–∏–∏, —ò–∞–±–æ–ª–∫–∞ –∏ –≥–æ—Ä—á–ª–∏–≤–∏ –±–∞–¥–µ–º–∏, –æ–¥ –∫–æ–∏ —Å–µ –¥–æ–±–∏–≤–∞–∞—Ç –±–∞–¥–µ–º–æ–≤–æ –º–∞—Å–ª–æ –∏ –∞—Ä–æ–º–∏. –ú–Ω–æ–≥—É –æ–¥ –æ–≤–∏–µ —ò–∞–º–∏ —Å–æ–¥—Ä–∂–∞—Ç –º–∞–ª–∏ –∫–æ–ª–∏—á–∏–Ω–∏ –Ω–∞ —Ü–∏—ò–∞–Ω–æ—Ö–∏–¥—Ä–∏–Ω–∏ –∫–∞–∫–æ —à—Ç–æ —Å–µ –º–∞–Ω–¥–µ–ª–æ–Ω–∏—Ç—Ä–∏–ª –∏ –∞–º–∏–≥–¥–∞–ª–∏–Ω, –∫–æ–∏ –ø–æ–ª–µ–∫–∞ –æ—Å–ª–æ–±–æ–¥—É–≤–∞–∞—Ç —Ü–∏—ò–∞–Ω–æ–≤–æ–¥–æ—Ä–æ–¥.[25][26] –°—Ç–æ –≥—Ä–∞–º–∞ –º–µ–ª–µ–Ω–∏ —Å–µ–º–∫–∏ –æ–¥ —ò–∞–±–æ–ª–∫–∞ –º–æ–∂–∞—Ç –¥–∞ –¥–∞–¥–∞—Ç –æ–∫–æ–ª—É 70 mg HCN.[27] –¢–∞–∫–∞–Ω–∞—Ä–µ—á–µ–Ω–∏—Ç–µ ‚Äû–≥–æ—Ä—á–ª–∏–≤–∏‚Äú –∫–æ—Ä–µ–Ω–∏ –Ω–∞ —Ä–∞—Å—Ç–µ–Ω–∏–µ—Ç–æ –º–∞–Ω–∏–æ–∫–∞ –º–æ–∂–µ –¥–∞ —Å–æ–¥—Ä–∂–∞—Ç –¥–æ 1 –≥—Ä–∞–º HCN –Ω–∞ –∫–∏–ª–æ–≥—Ä–∞–º.[28][29] –ù–µ–∫–æ–∏ –º–∏–ª–∏–ø–µ–¥–∏, –∫–∞–∫–æ —à—Ç–æ —Å–µ Harpaphe haydeniana, Desmoxytes purpurosea –∏ Apheloria –æ—Å–ª–æ–±–æ–¥—É–≤–∞–∞—Ç —Ü–∏—ò–∞–Ω–æ–≤–æ–¥–æ—Ä–æ–¥ –∫–∞–∫–æ –æ–¥–±—Ä–∞–Ω–±–µ–Ω –º–µ—Ö–∞–Ω–∏–∑–∞–º,[30] –∫–∞–∫–æ –∏ –æ–¥—Ä–µ–¥–µ–Ω–∏ –∏–Ω—Å–µ–∫—Ç–∏, –∫–∞–∫–æ —à—Ç–æ —Å–µ –º–æ–ª—Ü–∏—Ç–µ –∏ –ª–∞—Ä–≤–∏—Ç–µ –Ω–∞ Paropsisterna eucalyptus.[31] –¶–∏—ò–∞–Ω–æ–≤–æ–¥–æ—Ä–æ–¥ —Å–µ —Å–æ–¥—Ä–∂—É–≤–∞ –≤–æ –∏–∑–¥—É–≤–Ω–∏—Ç–µ –≥–∞—Å–æ–≤–∏ –Ω–∞ –≤–æ–∑–∏–ª–∞—Ç–∞ –∏ –≤–æ —á–∞–¥–æ—Ç –æ–¥ —Å–æ–≥–æ—Ä—É–≤–∞—ö–µ—Ç–æ –Ω–∞ –ø–ª–∞—Å—Ç–∏–∫–∞—Ç–∞ —à—Ç–æ —Å–æ–¥—Ä–∂–∏ –∞–∑–æ—Ç.  HCN –Ω–∞ –¢–∏—Ç–∞–ΩHCN –µ –∏–∑–º–µ—Ä–µ–Ω –≤–æ –∞—Ç–º–æ—Å—Ñ–µ—Ä–∞—Ç–∞ –Ω–∞ –¢–∏—Ç–∞–Ω —Å–æ —á–µ—Ç–∏—Ä–∏ –∏–Ω—Å—Ç—Ä—É–º–µ–Ω—Ç–∏ –Ω–∞ –≤—Å–µ–ª–µ–Ω—Å–∫–∞—Ç–∞ —Å–æ–Ω–¥–∞ –ö–∞—Å–∏–Ω–∏, –µ–¥–µ–Ω –∏–Ω—Å—Ç—Ä—É–º–µ–Ω—Ç –Ω–∞ –í–æ—ò–∞—ü–µ—Ä –∏ –µ–¥–µ–Ω –∏–Ω—Å—Ç—Ä—É–º–µ–Ω—Ç –Ω–∞ –ó–µ–º—ò–∞—Ç–∞.[32] –ï–¥–Ω–æ –æ–¥ –æ–≤–∏–µ –º–µ—Ä–µ—ö–∞ –±–∏–ª–æ –Ω–∞ —Å–∞–º–æ—Ç–æ –º–µ—Å—Ç–æ, –∫–∞–¥–µ —à—Ç–æ –ª–µ—Ç–∞–ª–æ—Ç–æ –ö–∞—Å–∏–Ω–∏ –ø–∞–¥–Ω–∞–ª–æ –ø–æ–º–µ—ì—É 1,000 –∏ 1,100 –∫–º (620 –∏ 680 mi) –Ω–∞–¥ –ø–æ–≤—Ä—à–∏–Ω–∞—Ç–∞ –Ω–∞ –¢–∏—Ç–∞–Ω –∑–∞ —Å–æ–±–∏—Ä–∞—ö–µ –Ω–∞ –∞—Ç–º–æ—Å—Ñ–µ—Ä—Å–∫–∏ –≥–∞—Å –∑–∞ –∞–Ω–∞–ª–∏–∑–∞ —Å–æ –º–∞—Å–µ–Ω–∞ —Å–ø–µ–∫—Ç—Ä–æ–º–µ—Ç—Ä–∏—ò–∞.[33] HCN –ø—Ä–≤–∏—á–Ω–æ —Å–µ —Ñ–æ—Ä–º–∏—Ä–∞–ª –≤–æ –∞—Ç–º–æ—Å—Ñ–µ—Ä–∞—Ç–∞ –Ω–∞ –¢–∏—Ç–∞–Ω –ø—Ä–µ–∫—É —Ä–µ–∞–∫—Ü–∏—ò–∞ –Ω–∞ —Ñ–æ—Ç–æ—Ö–µ–º–∏—Å–∫–∏ –ø—Ä–æ–∏–∑–≤–µ–¥–µ–Ω–∏—Ç–µ –º–µ—Ç–∞–Ω –∏ –∞–∑–æ—Ç–Ω–∏ —Ä–∞–¥–∏–∫–∞–ª–∏ –∫–æ–∏ –ø—Ä–æ–¥–æ–ª–∂—É–≤–∞–∞—Ç –Ω–∏–∑ H 2 CN –ø–æ—Å—Ä–µ–¥–Ω–∏–∫, –Ω–∞ –ø—Ä., (CH 3 + N ‚Üí H 2 CN + H ‚Üí HCN + H 2 ).[34][35] –£–ª—Ç—Ä–∞–≤–∏–æ–ª–µ—Ç–æ–≤–æ—Ç–æ –∑—Ä–∞—á–µ—ö–µ –≥–æ —Ä–∞–∑–ª–æ–∂—É–≤–∞ HCN –Ω–∞ CN + H; —Å–µ–ø–∞–∫, CN –µ—Ñ–∏–∫–∞—Å–Ω–æ —Å–µ —Ä–µ—Ü–∏–∫–ª–∏—Ä–∞ –Ω–∞–∑–∞–¥ –≤–æ HCN –ø—Ä–µ–∫—É —Ä–µ–∞–∫—Ü–∏—ò–∞—Ç–∞ CN + CH 4 ‚Üí HCN + CH3.[34] HCN –Ω–∞ –º–ª–∞–¥–∞—Ç–∞ –ó–µ–º—ò–∞–°–µ –ø—Ä–µ—Ç–ø–æ—Å—Ç–∞–≤—É–≤–∞ –¥–µ–∫–∞ —ò–∞–≥–ª–µ—Ä–æ–¥–æ—Ç –æ–¥ –∫–∞—Å–∫–∞–¥–∞ –æ–¥ –∞—Å—Ç–µ—Ä–æ–∏–¥–∏ (–ø–æ–∑–Ω–∞—Ç –∫–∞–∫–æ –¥–æ—Ü–Ω–æ —Ç–µ—à–∫–æ –±–æ–º–±–∞—Ä–¥–∏—Ä–∞—ö–µ ), –∫–∞–∫–æ —Ä–µ–∑—É–ª—Ç–∞—Ç –Ω–∞ –∏–Ω—Ç–µ—Ä–∞–∫—Ü–∏—ò–∞—Ç–∞ –Ω–∞ –à—É–ø–∏—Ç–µ—Ä –∏ –°–∞—Ç—É—Ä–Ω, —ò–∞ —Ä–∞–∑–Ω–µ–ª –ø–æ–≤—Ä—à–∏–Ω–∞—Ç–∞ –Ω–∞ –º–ª–∞–¥–∞—Ç–∞ –ó–µ–º—ò–∞ –∏ —Ä–µ–∞–≥–∏—Ä–∞–ª —Å–æ –∞–∑–æ—Ç –≤–æ –∞—Ç–º–æ—Å—Ñ–µ—Ä–∞—Ç–∞ –Ω–∞ –ó–µ–º—ò–∞—Ç–∞ –∑–∞ –¥–∞ —Ñ–æ—Ä–º–∏—Ä–∞ HCN.[36] HCN –∫–∞—ò —Ü–∏—Ü–∞—á–∏—Ç–µ–ù–µ–∫–æ–∏ –∞–≤—Ç–æ—Ä–∏ –ø–æ–∫–∞–∂–∞–ª–µ –¥–µ–∫–∞ –Ω–µ–≤—Ä–æ–Ω–∏—Ç–µ –º–æ–∂–∞—Ç –¥–∞ –ø—Ä–æ–∏–∑–≤–µ–¥–∞—Ç —Ü–∏—ò–∞–Ω–æ–≤–æ–¥–æ—Ä–æ–¥ –ø—Ä–∏ –∞–∫—Ç–∏–≤–∏—Ä–∞—ö–µ –Ω–∞ –Ω–∏–≤–Ω–∏—Ç–µ –æ–ø–∏–æ–∏–¥–Ω–∏ —Ä–µ—Ü–µ–ø—Ç–æ—Ä–∏ –æ–¥ –µ–Ω–¥–æ–≥–µ–Ω–∏ –∏–ª–∏ –µ–≥–∑–æ–≥–µ–Ω–∏ –æ–ø–∏–æ–∏–¥–∏. –¢–∏–µ –∏—Å—Ç–æ —Ç–∞–∫–∞ –ø–æ–∫–∞–∂–∞–ª–µ –¥–µ–∫–∞ –Ω–µ–≤—Ä–æ–Ω—Å–∫–æ—Ç–æ –ø—Ä–æ–∏–∑–≤–æ–¥—Å—Ç–≤–æ –Ω–∞ HCN –≥–∏ –∞–∫—Ç–∏–≤–∏—Ä–∞ NMDA —Ä–µ—Ü–µ–ø—Ç–æ—Ä–∏—Ç–µ –∏ –∏–≥—Ä–∞ —É–ª–æ–≥–∞ –≤–æ —Ç—Ä–∞–Ω—Å–¥—É–∫—Ü–∏—ò–∞—Ç–∞ –Ω–∞ —Å–∏–≥–Ω–∞–ª–æ—Ç –ø–æ–º–µ—ì—É –Ω–µ–≤—Ä–æ–Ω—Å–∫–∏—Ç–µ –∫–ª–µ—Ç–∫–∏ (–Ω–µ–≤—Ä–æ—Ç—Ä–∞–Ω—Å–º–∏—Å–∏—ò–∞). –ó–≥–æ—Ä–∞ –Ω–∞ —Ç–æ–∞, –∑–≥–æ–ª–µ–º–µ–Ω–æ—Ç–æ –ø—Ä–æ–∏–∑–≤–æ–¥—Å—Ç–≤–æ –Ω–∞ –µ–Ω–¥–æ–≥–µ–Ω–∏ –Ω–µ–≤—Ä–æ–Ω—Å–∫–∏ HCN –ø–æ–¥ –æ–ø–∏–æ–∏–¥–∏ –±–∏–ª–æ –Ω–∞–≤–∏–¥—É–º –ø–æ—Ç—Ä–µ–±–Ω–æ –∑–∞ –∞–¥–µ–∫–≤–∞—Ç–Ω–∞ –æ–ø–∏–æ–∏–¥–Ω–∞ –∞–Ω–∞–ª–≥–µ–∑–∏—ò–∞, –±–∏–¥–µ—ò—ú–∏ –∞–Ω–∞–ª–≥–µ—Ç—Å–∫–æ—Ç–æ –¥–µ—ò—Å—Ç–≤–æ –Ω–∞ –æ–ø–∏–æ–∏–¥–∏—Ç–µ –±–∏–ª–æ –∞—Ç–µ–Ω—É–∏—Ä–∞–Ω–æ –æ–¥ —á–∏—Å—Ç–∞—á–∏—Ç–µ –Ω–∞ HCN. –¢–∏–µ —Å–º–µ—Ç–∞–ª–µ –¥–µ–∫–∞ –µ–Ω–¥–æ–≥–µ–Ω–∏–æ—Ç HCN –µ –Ω–µ–≤—Ä–æ–º–æ–¥—É–ª–∞—Ç–æ—Ä.[37] –ò—Å—Ç–æ —Ç–∞–∫–∞, —Å–µ –ø–æ–∫–∞–∂–∞–ª–æ –¥–µ–∫–∞, –¥–æ–¥–µ–∫–∞ —Å—Ç–∏–º—É–ª–∏—Ä–∞—ö–µ—Ç–æ –Ω–∞ –º—É—Å–∫–∞—Ä–∏–Ω—Å–∫–∏—Ç–µ —Ö–æ–ª–∏–Ω–µ—Ä–≥–∏—á–Ω–∏ —Ä–µ—Ü–µ–ø—Ç–æ—Ä–∏ –≤–æ –∫—É–ª—Ç–∏–≤–∏—Ä–∞–Ω–∏—Ç–µ –∫–ª–µ—Ç–∫–∏ –Ω–∞ —Ñ–µ–æ—Ö—Ä–æ–º–æ—Ü–∏—Ç–æ–º –≥–æ –∑–≥–æ–ª–µ–º—É–≤–∞ –ø—Ä–æ–∏–∑–≤–æ–¥—Å—Ç–≤–æ—Ç–æ –Ω–∞ HCN, –≤–æ –∂–∏–≤ –æ—Ä–≥–∞–Ω–∏–∑–∞–º (in vivo) –º—É—Å–∫–∞—Ä–∏–Ω—Å–∫–∞—Ç–∞ —Ö–æ–ª–∏–Ω–µ—Ä–≥–∏—á–Ω–∞ —Å—Ç–∏–º—É–ª–∞—Ü–∏—ò–∞ –≤—Å—É—à–Ω–æ—Å—Ç –≥–æ –Ω–∞–º–∞–ª—É–≤–∞ –ø—Ä–æ–∏–∑–≤–æ–¥—Å—Ç–≤–æ—Ç–æ –Ω–∞ HCN.[38] –õ–µ—É–∫–æ—Ü–∏—Ç–∏—Ç–µ –≥–µ–Ω–µ—Ä–∏—Ä–∞–∞—Ç HCN –∑–∞ –≤—Ä–µ–º–µ –Ω–∞ —Ñ–∞–≥–æ—Ü–∏—Ç–æ–∑–∞—Ç–∞ –∏ –º–æ–∂–∞—Ç –¥–∞ —É–±–∏—ò–∞—Ç –±–∞–∫—Ç–µ—Ä–∏–∏, –≥–∞–±–∏ –∏ –¥—Ä—É–≥–∏ –ø–∞—Ç–æ–≥–µ–Ω–∏ —Å–æ –≥–µ–Ω–µ—Ä–∏—Ä–∞—ö–µ –Ω–∞ –Ω–µ–∫–æ–ª–∫—É —Ä–∞–∑–ª–∏—á–Ω–∏ —Ç–æ–∫—Å–∏—á–Ω–∏ —Ö–µ–º–∏–∫–∞–ª–∏–∏, –æ–¥ –∫–æ–∏ –µ–¥–Ω–∞—Ç–∞ –µ —Ü–∏—ò–∞–Ω–æ–≤–æ–¥–æ—Ä–æ–¥.[37] –í–∞–∑–æ–¥–∏–ª–∞—Ç–∞—Ü–∏—ò–∞ –ø—Ä–µ–¥–∏–∑–≤–∏–∫–∞–Ω–∞ –æ–¥ –Ω–∞—Ç—Ä–∏—É–º –Ω–∏—Ç—Ä–æ–ø—Ä—É—Å–∏–¥ —Å–µ –ø–æ–∫–∞–∂–∞ –¥–µ–∫–∞ –µ –ø–æ—Å—Ä–µ–¥—É–≤–∞–Ω–∞ –Ω–µ —Å–∞–º–æ –æ–¥ –≥–µ–Ω–µ—Ä–∏—Ä–∞—ö–µ—Ç–æ –Ω–∞ NO, —Ç—É–∫—É –∏ –æ–¥ –µ–Ω–¥–æ–≥–µ–Ω–æ—Ç–æ –≥–µ–Ω–µ—Ä–∏—Ä–∞—ö–µ –Ω–∞ —Ü–∏—ò–∞–Ω–∏–¥–∏, –∫–æ–µ –¥–æ–¥–∞–≤–∞ –Ω–µ —Å–∞–º–æ —Ç–æ–∫—Å–∏—á–Ω–æ—Å—Ç, —Ç—É–∫—É –∏ –æ–¥—Ä–µ–¥–µ–Ω–∞ –¥–æ–ø–æ–ª–Ω–∏—Ç–µ–ª–Ω–∞ –∞–Ω—Ç–∏—Ö–∏–ø–µ—Ä—Ç–µ–Ω–∑–∏–≤–Ω–∞ –µ—Ñ–∏–∫–∞—Å–Ω–æ—Å—Ç –≤–æ —Å–ø–æ—Ä–µ–¥–±–∞ —Å–æ –Ω–∏—Ç—Ä–æ–≥–ª–∏—Ü–µ—Ä–∏–Ω–æ—Ç –∏ –¥—Ä—É–≥–∏—Ç–µ –Ω–µ—Ü–∏—ò–∞–Ω–æ–≥–µ–Ω–∏ –Ω–∏—Ç—Ä–∞—Ç–∏ –∫–æ–∏ –Ω–µ –ø—Ä–µ–¥–∏–∑–≤–∏–∫—É–≤–∞–∞—Ç –¥–∞ —Å–µ –∑–≥–æ–ª–µ–º–∏ –Ω–∏–≤–æ—Ç–æ –Ω–∞ —Ü–∏—ò–∞–Ω–∏–¥ –≤–æ –∫—Ä–≤—Ç–∞.[39] HCN –µ —Å–æ—Å—Ç–∞–≤–µ–Ω –¥–µ–ª –Ω–∞ —á–∞–¥–æ—Ç –æ–¥ —Ç—É—Ç—É–Ω.[40] HCN –∏ –ø–æ—Ç–µ–∫–ª–æ—Ç–æ –Ω–∞ –∂–∏–≤–æ—Ç–æ—Ç–¶–∏—ò–∞–Ω–æ–≤–æ–¥–æ—Ä–æ–¥–æ—Ç –µ –¥–∏—Å–∫—É—Ç–∏—Ä–∞–Ω –∫–∞–∫–æ –ø—Ä–µ—Ç—Ö–æ–¥–Ω–∏–∫ –Ω–∞ –∞–º–∏–Ω–æ–∫–∏—Å–µ–ª–∏–Ω–∏—Ç–µ –∏ –Ω—É–∫–ª–µ–∏–Ω—Å–∫–∏—Ç–µ –∫–∏—Å–µ–ª–∏–Ω–∏ –∏ —Å–µ –ø—Ä–µ–¥–ª–∞–≥–∞ –¥–µ–∫–∞ –∏–≥—Ä–∞–ª —É–ª–æ–≥–∞ –≤–æ –ø–æ—Ç–µ–∫–ª–æ—Ç–æ –Ω–∞ –∂–∏–≤–æ—Ç–æ—Ç.[41] –ò–∞–∫–æ –≤—Ä—Å–∫–∞—Ç–∞ –Ω–∞ –æ–≤–∏–µ —Ö–µ–º–∏—Å–∫–∏ —Ä–µ–∞–∫—Ü–∏–∏ —Å–æ –ø–æ—Ç–µ–∫–ª–æ—Ç–æ –Ω–∞ —Ç–µ–æ—Ä–∏—ò–∞—Ç–∞ –Ω–∞ –∂–∏–≤–æ—Ç–æ—Ç –æ—Å—Ç–∞–Ω—É–≤–∞ —à–ø–µ–∫—É–ª–∞—Ç–∏–≤–Ω–∞, —Å—Ç—É–¥–∏–∏—Ç–µ –≤–æ –æ–≤–∞–∞ –æ–±–ª–∞—Å—Ç –¥–æ–≤–µ–ª–µ –¥–æ –æ—Ç–∫—Ä–∏—Ç–∏—ò–∞ –Ω–∞ –Ω–æ–≤–∏ –ø–∞—Ç–∏—à—Ç–∞ –¥–æ –æ—Ä–≥–∞–Ω—Å–∫–∏ —Å–æ–µ–¥–∏–Ω–µ–Ω–∏—ò–∞ –¥–æ–±–∏–µ–Ω–∏ –æ–¥ –∫–æ–Ω–¥–µ–Ω–∑–∞—Ü–∏—ò–∞—Ç–∞ –Ω–∞ HCN (–Ω–∞ –ø—Ä. –ê–¥–µ–Ω–∏–Ω).[42] HCN –≤–æ –≤—Å–µ–ª–µ–Ω–∞—Ç–∞HCN –µ –æ—Ç–∫—Ä–∏–µ–Ω –≤–æ –º–µ—ì—É—ï–≤–µ–∑–¥–µ–Ω–∞—Ç–∞ —Å—Ä–µ–¥–∏–Ω–∞ [43] –∏ –≤–æ –∞—Ç–º–æ—Å—Ñ–µ—Ä–∏—Ç–µ –Ω–∞ —ò–∞–≥–ª–µ—Ä–æ–¥–Ω–∏—Ç–µ —ï–≤–µ–∑–¥–∏.[44] –û—Ç—Ç–æ–≥–∞—à, –æ–±–µ–º–Ω–∏ —Å—Ç—É–¥–∏–∏ –≥–∏ –∏—Å–ø–∏—Ç—É–≤–∞–ª–µ –ø–∞—Ç–∏—à—Ç–∞—Ç–∞ –Ω–∞ —Ñ–æ—Ä–º–∏—Ä–∞—ö–µ –∏ —É–Ω–∏—à—Ç—É–≤–∞—ö–µ –Ω–∞ HCN –≤–æ —Ä–∞–∑–ª–∏—á–Ω–∏ —Å—Ä–µ–¥–∏–Ω–∏ –∏ —ò–∞ –∏—Å–ø–∏—Ç—É–≤–∞–ª–µ –Ω–µ–≥–æ–≤–∞—Ç–∞ —É–ø–æ—Ç—Ä–µ–±–∞ –∫–∞–∫–æ —Ç—Ä–∞–≥–∞—á –∑–∞ —Ä–∞–∑–ª–∏—á–Ω–∏ –∞—Å—Ç—Ä–æ–Ω–æ–º—Å–∫–∏ –≤–∏–¥–æ–≤–∏ –∏ –ø—Ä–æ—Ü–µ—Å–∏. HCN –º–æ–∂–µ –¥–∞ —Å–µ –Ω–∞–±—ô—É–¥—É–≤–∞ –æ–¥ —Ç–µ–ª–µ—Å–∫–æ–ø–∏ –Ω–∞ –∑–µ–º—ò–∞ –ø—Ä–µ–∫—É –≥–æ–ª–µ–º –±—Ä–æ—ò –∞—Ç–º–æ—Å—Ñ–µ—Ä—Å–∫–∏ –ø—Ä–æ–∑–æ—Ä—Ü–∏.[45] –°–∏—Ç–µ J=1‚Üí0, J=3‚Üí2, J= 4‚Üí3 –∏ J=10‚Üí9 —á–∏—Å—Ç–∏ —Ä–æ—Ç–∞—Ü–∏–æ–Ω–∏ —Ç—Ä–∞–Ω–∑–∏—Ü–∏–∏ —Å–µ –∑–∞–±–µ–ª–µ–∂–∞–Ω–∏.[43][46][47] HCN —Å–µ —Ñ–æ—Ä–º–∏—Ä–∞ –≤–æ –º–µ—ì—É—ï–≤–µ–∑–¥–µ–Ω–∏ –æ–±–ª–∞—Ü–∏ –ø—Ä–µ–∫—É –µ–¥–Ω–∞ –æ–¥ –¥–≤–µ—Ç–µ –≥–ª–∞–≤–Ω–∏ –ø–∞—Ç–∏—à—Ç–∞:[48] –ø—Ä–µ–∫—É –Ω–µ—É—Ç—Ä–∞–ª–Ω–æ-–Ω–µ—É—Ç—Ä–∞–ª–Ω–∞ —Ä–µ–∞–∫—Ü–∏—ò–∞ (CH 2 + N ‚Üí HCN + H) –∏ –ø—Ä–µ–∫—É –¥–∏—Å–æ—Ü–∏—ò–∞—Ç–∏–≤–Ω–∞ —Ä–µ–∫–æ–º–±–∏–Ω–∞—Ü–∏—ò–∞ (HCNH + + e - ‚Üí HCN + H). –î–∏—Å–æ—Ü–∏—ò–∞—Ç–∏–≤–Ω–∞—Ç–∞ –ø–∞—Ç–µ–∫–∞ –Ω–∞ —Ä–µ–∫–æ–º–±–∏–Ω–∞—Ü–∏—ò–∞ –µ –¥–æ–º–∏–Ω–∞–Ω—Ç–Ω–∞ –∑–∞ 30%; —Å–µ–ø–∞–∫, HCNH <sup id="mwAZA">+</sup> –º–æ—Ä–∞ –¥–∞ –±–∏–¥–µ –≤–æ –ª–∏–Ω–µ–∞—Ä–Ω–∞ —Ñ–æ—Ä–º–∞. –î–∏—Å–æ—Ü–∏—ò–∞—Ç–∏–≤–Ω–∞—Ç–∞ —Ä–µ–∫–æ–º–±–∏–Ω–∞—Ü–∏—ò–∞ —Å–æ –Ω–µ–≥–æ–≤–∏–æ—Ç —Å—Ç—Ä—É–∫—Ç—É—Ä–µ–Ω –∏–∑–æ–º–µ—Ä, H 2 NC +, –∏—Å–∫–ª—É—á–∏–≤–æ –ø—Ä–æ–∏–∑–≤–µ–¥—É–≤–∞ –≤–æ–¥–æ—Ä–æ–¥–µ–Ω –∏–∑–æ—Ü–∏—ò–∞–Ω–∏–¥ (HNC). HCN —Å–µ —É–Ω–∏—à—Ç—É–≤–∞ –≤–æ –º–µ—ì—É—ï–≤–µ–∑–¥–µ–Ω–∏—Ç–µ –æ–±–ª–∞—Ü–∏ –ø—Ä–µ–∫—É –≥–æ–ª–µ–º –±—Ä–æ—ò –º–µ—Ö–∞–Ω–∏–∑–º–∏ –≤–æ –∑–∞–≤–∏—Å–Ω–æ—Å—Ç –æ–¥ –ª–æ–∫–∞—Ü–∏—ò–∞—Ç–∞ –≤–æ –æ–±–ª–∞–∫–æ—Ç.[48] –í–æ —Ä–µ–≥–∏–æ–Ω–∏—Ç–µ –¥–æ–º–∏–Ω–∏—Ä–∞–Ω–∏ –æ–¥ —Ñ–æ—Ç–æ–Ω–∏ (PDRs), –¥–æ–º–∏–Ω–∏—Ä–∞ —Ñ–æ—Ç–æ–¥–∏—Å–æ—Ü–∏—ò–∞—Ü–∏—ò–∞—Ç–∞, –ø—Ä–æ–∏–∑–≤–µ–¥—É–≤–∞—ò—ú–∏ CN (HCN + ŒΩ ‚Üí CN + H). –ù–∞ –ø–æ–Ω–∞—Ç–∞–º–æ—à–Ω–∏ –¥–ª–∞–±–æ—á–∏–Ω–∏, —Ñ–æ—Ç–æ–¥–∏—Å–æ—Ü–∏—ò–∞—Ü–∏—ò–∞—Ç–∞ —Å–æ –∫–æ—Å–º–∏—á–∫–∏—Ç–µ –∑—Ä–∞—Ü–∏ –¥–æ–º–∏–Ω–∏—Ä–∞, –ø—Ä–æ–∏–∑–≤–µ–¥—É–≤–∞—ò—ú–∏ CN (HCN + cr ‚Üí CN + H). –í–æ —Ç–µ–º–Ω–æ—Ç–æ —ò–∞–¥—Ä–æ, –¥–≤–∞ –∫–æ–Ω–∫—É—Ä–µ–Ω—Ç–Ω–∏ –º–µ—Ö–∞–Ω–∏–∑–º–∏ –≥–æ —É–Ω–∏—à—Ç—É–≤–∞–∞—Ç, —Ñ–æ—Ä–º–∏—Ä–∞—ò—ú–∏ HCN + –∏ HCNH + (HCN + H + ‚Üí HCN + + H; HCN + HCO + ‚Üí HCNH + + CO). –Ý–µ–∞–∫—Ü–∏—ò–∞—Ç–∞ —Å–æ HCO + –¥–æ–º–∏–Ω–∏—Ä–∞ —Å–æ —Ñ–∞–∫—Ç–æ—Ä ~3,5. HCN —Å–µ –∫–æ—Ä–∏—Å—Ç–∏ –∑–∞ –∞–Ω–∞–ª–∏–∑–∞ –Ω–∞ —Ä–∞–∑–ª–∏—á–Ω–∏ –≤–∏–¥–æ–≤–∏ –∏ –ø—Ä–æ—Ü–µ—Å–∏ –≤–æ –º–µ—ì—É—ï–≤–µ–∑–¥–µ–Ω–∞—Ç–∞ —Å—Ä–µ–¥–∏–Ω–∞. –ü—Ä–µ–¥–ª–æ–∂–µ–Ω–æ –µ –∫–∞–∫–æ —Ç—Ä–∞–≥–∞—á –∑–∞ –≥—É—Å—Ç –º–æ–ª–µ–∫—É–ª–∞—Ä–µ–Ω –≥–∞—Å [49][50] –∏ –∫–∞–∫–æ —Ç—Ä–∞–≥–∞—á –Ω–∞ —ï–≤–µ–∑–¥–µ–Ω –ø—Ä–∏–ª–∏–≤ –≤–æ –æ–±–ª–∞—Å—Ç–∏—Ç–µ —à—Ç–æ —Ñ–æ—Ä–º–∏—Ä–∞–∞—Ç —ï–≤–µ–∑–¥–∏ —Å–æ –≥–æ–ª–µ–º–∞ –º–∞—Å–∞.[51] –ü–æ–Ω–∞—Ç–∞–º—É, —Å–æ–æ–¥–Ω–æ—Å–æ—Ç HNC/HCN —Å–µ –ø–æ–∫–∞–∂–∞–ª –∫–∞–∫–æ –æ–¥–ª–∏—á–µ–Ω –º–µ—Ç–æ–¥ –∑–∞ —Ä–∞–∑–ª–∏–∫—É–≤–∞—ö–µ –ø–æ–º–µ—ì—É PDR –∏ —Ä–µ–≥–∏–æ–Ω–∏ –¥–æ–º–∏–Ω–∏—Ä–∞–Ω–∏ —Å–æ –•-–∑—Ä–∞—Ü–∏ (XDRs).[52] –ù–∞ 11 –∞–≤–≥—É—Å—Ç 2014 –≥–æ–¥–∏–Ω–∞, –∞—Å—Ç—Ä–æ–Ω–æ–º–∏—Ç–µ –æ–±—ò–∞–≤–∏–ª–µ —Å—Ç—É–¥–∏–∏, –∫–æ—Ä–∏—Å—Ç–µ—ò—ú–∏ —ò–∞ –ì–æ–ª–µ–º–∞—Ç–∞ –º–∏–ª–∏–º–µ—Ç–∞—Ä—Å–∫–∞/–ø–æ–¥–º–∏–ª–∏–º–µ—Ç–∞—Ä—Å–∫–∞ –Ω–∏–∑–∞ –ê—Ç–∞–∫–∞–º–∞ (ALMA) –∑–∞ –ø—Ä–≤ –ø–∞—Ç, –∫–æ–∏ —ò–∞ –¥–µ—Ç–∞–ª–∏–∑–∏—Ä–∞–ª–µ –¥–∏—Å—Ç—Ä–∏–±—É—Ü–∏—ò–∞—Ç–∞ –Ω–∞ HCN, HNC, H2CO –∏ –ø—Ä–∞—à–∏–Ω–∞—Ç–∞ –≤–æ –∫–æ–º–∞—Ç–∞ –Ω–∞ –∫–æ–º–µ—Ç–∏—Ç–µ C/2012 F6 ( Lemmon) –∏ C/2012 S1 (ISON).[53][54] –í–æ —Ñ–µ–≤—Ä—É–∞—Ä–∏ 2016 –≥–æ–¥–∏–Ω–∞, –±–∏–ª–æ –æ–±—ò–∞–≤–µ–Ω–æ –¥–µ–∫–∞ —Ç—Ä–∞–≥–∏ –æ–¥ —Ü–∏—ò–∞–Ω–æ–≤–æ–¥–æ—Ä–æ–¥ —Å–µ –ø—Ä–æ–Ω–∞—ò–¥–µ–Ω–∏ –≤–æ –∞—Ç–º–æ—Å—Ñ–µ—Ä–∞—Ç–∞ –Ω–∞ –∂–µ—à–∫–∞—Ç–∞ –°—É–ø–µ—Ä-–ó–µ–º—ò–∞ 55 Cancri e —Å–æ –≤—Å–µ–ª–µ–Ω—Å–∫–∏–æ—Ç —Ç–µ–ª–µ—Å–∫–æ–ø –•–∞–±–ª –Ω–∞ –ù–ê–°–ê.[55] –ö–∞–∫–æ –æ—Ç—Ä–æ–≤ –∏ —Ö–µ–º–∏—Å–∫–æ –æ—Ä—É–∂—ò–µ–í–æ –ü—Ä–≤–∞—Ç–∞ —Å–≤–µ—Ç—Å–∫–∞ –≤–æ—ò–Ω–∞, —Ü–∏—ò–∞–Ω–æ–≤–æ–¥–æ—Ä–æ–¥–æ—Ç –≥–æ –∫–æ—Ä–∏—Å—Ç–µ–ª–µ –§—Ä–∞–Ω—Ü—É–∑–∏—Ç–µ –æ–¥ 1916 –≥–æ–¥–∏–Ω–∞ –∫–∞–∫–æ —Ö–µ–º–∏—Å–∫–æ –æ—Ä—É–∂—ò–µ –ø—Ä–æ—Ç–∏–≤ –¶–µ–Ω—Ç—Ä–∞–ª–Ω–∏—Ç–µ —Å–∏–ª–∏, –∞ –°–ê–î –∏ –ò—Ç–∞–ª–∏—ò–∞ –≤–æ 1918 –≥–æ–¥–∏–Ω–∞. –°–µ –ø–æ–∫–∞–∂–∞–ª–æ –¥–µ–∫–∞ –Ω–µ –µ –¥–æ–≤–æ–ª–Ω–æ –µ—Ñ–∏–∫–∞—Å–µ–Ω –ø–æ—Ä–∞–¥–∏ –≤—Ä–µ–º–µ–Ω—Å–∫–∏—Ç–µ —É—Å–ª–æ–≤–∏.[56][57] –ì–∞—Å–æ—Ç –µ –ø–æ–ª–µ—Å–µ–Ω –æ–¥ –≤–æ–∑–¥—É—Ö–æ—Ç –∏ –±—Ä–∑–æ —Å–µ —Ä–∞—Å–ø—Ä—Å–Ω—É–≤–∞ –≤–æ –∞—Ç–º–æ—Å—Ñ–µ—Ä–∞—Ç–∞. –ë—Ä–∑–æ—Ç–æ —Ä–∞–∑—Ä–µ–¥—É–≤–∞—ö–µ —ò–∞ –Ω–∞–ø—Ä–∞–≤–∏–ª–æ –Ω–µ–≥–æ–≤–∞—Ç–∞ —É–ø–æ—Ç—Ä–µ–±–∞ –Ω–∞ —Ç–µ—Ä–µ–Ω –Ω–µ–ø—Ä–∞–∫—Ç–∏—á–Ω–∞. –°–ø—Ä–æ—Ç–∏–≤–Ω–æ –Ω–∞ —Ç–æ–∞, –ø–æ–≥—É—Å—Ç–∏—Ç–µ –∞–≥–µ–Ω—Å–∏ –∫–∞–∫–æ —Ñ–æ—Å–≥–µ–Ω –∏–ª–∏ —Ö–ª–æ—Ä –∏–º–∞–∞—Ç —Ç–µ–Ω–¥–µ–Ω—Ü–∏—ò–∞ –¥–∞ –æ—Å—Ç–∞–Ω–∞—Ç –Ω–∞ –Ω–∏–≤–æ—Ç–æ –Ω–∞ –∑–µ–º—ò–∞—Ç–∞ –∏ –¥–∞ –ø–æ—Ç–æ–Ω–∞—Ç –≤–æ —Ä–æ–≤–æ–≤–∏—Ç–µ –Ω–∞ –±–æ–∏—à—Ç–∞—Ç–∞ –Ω–∞ –ó–∞–ø–∞–¥–Ω–∏–æ—Ç —Ñ—Ä–æ–Ω—Ç. –í–æ —Å–ø–æ—Ä–µ–¥–±–∞ —Å–æ —Ç–∞–∫–≤–∏—Ç–µ —Å—Ä–µ–¥—Å—Ç–≤–∞, —Ü–∏—ò–∞–Ω–æ–≤–æ–¥–æ—Ä–æ–¥–æ—Ç –º–æ—Ä–∞–ª–æ –¥–∞ –±–∏–¥–µ –ø—Ä–∏—Å—É—Ç–µ–Ω –≤–æ –ø–æ–≤–∏—Å–æ–∫–∏ –∫–æ–Ω—Ü–µ–Ω—Ç—Ä–∞—Ü–∏–∏ –∑–∞ –¥–∞ –±–∏–¥–µ —Ñ–∞—Ç–∞–ª–µ–Ω. –ö–æ–Ω—Ü–µ–Ω—Ç—Ä–∞—Ü–∏—ò–∞—Ç–∞ –Ω–∞ —Ü–∏—ò–∞–Ω–æ–≤–æ–¥–æ—Ä–æ–¥ –æ–¥ 100-200 ppm –≤–æ –≤–æ–∑–¥—É—Ö–æ—Ç —à—Ç–æ –≤–¥–∏—à—É–≤–∞ —ú–µ —É–±–∏–µ —á–æ–≤–µ–∫ –≤–æ —Ä–æ–∫ –æ–¥ 10 –¥–æ 60 –º–∏–Ω—É—Ç–∏. –ö–æ–Ω—Ü–µ–Ω—Ç—Ä–∞—Ü–∏—ò–∞ –Ω–∞ —Ü–∏—ò–∞–Ω–æ–≤–æ–¥–æ—Ä–æ–¥ –æ–¥ 2000 ppm (–æ–∫–æ–ª—É 2380 mg/m 3 ) —ú–µ —É–±–∏–µ —á–æ–≤–µ–∫ –∑–∞ –æ–∫–æ–ª—É –µ–¥–Ω–∞ –º–∏–Ω—É—Ç–∞. –¢–æ–∫—Å–∏—á–Ω–∏–æ—Ç –µ—Ñ–µ–∫—Ç –µ –ø—Ä–µ–¥–∏–∑–≤–∏–∫–∞–Ω –æ–¥ –¥–µ—ò—Å—Ç–≤–æ—Ç–æ –Ω–∞ —Ü–∏—ò–∞–Ω–∏–¥–Ω–∏–æ—Ç —ò–æ–Ω, –∫–æ—ò –≥–æ –∑–∞–ø–∏—Ä–∞ –∫–ª–µ—Ç–æ—á–Ω–æ—Ç–æ –¥–∏—à–µ—ö–µ. –î–µ—ò—Å—Ç–≤—É–≤–∞ –∫–∞–∫–æ –Ω–µ–∫–æ–Ω–∫—É—Ä–µ–Ω—Ç–µ–Ω –∏–Ω—Ö–∏–±–∏—Ç–æ—Ä –∑–∞ –µ–Ω–∑–∏–º–æ—Ç –≤–æ –º–∏—Ç–æ—Ö–æ–Ω–¥—Ä–∏–∏—Ç–µ –Ω–∞—Ä–µ—á–µ–Ω —Ü–∏—Ç–æ—Ö—Ä–æ–º c –æ–∫—Å–∏–¥–∞–∑–∞. –ö–∞–∫–æ —Ç–∞–∫–æ–≤, —Ü–∏—ò–∞–Ω–æ–≤–æ–¥–æ—Ä–æ–¥–æ—Ç –µ –≤–æ–æ–±–∏—á–∞–µ–Ω–æ –Ω–∞–≤–µ–¥–µ–Ω –º–µ—ì—É —Ö–µ–º–∏—Å–∫–æ—Ç–æ –æ—Ä—É–∂—ò–µ –∫–∞–∫–æ –∫—Ä–≤–µ–Ω –∞–≥–µ–Ω—Å.[58] –ö–æ–Ω–≤–µ–Ω—Ü–∏—ò–∞—Ç–∞ –∑–∞ —Ö–µ–º–∏—Å–∫–æ –æ—Ä—É–∂—ò–µ –≥–æ –Ω–∞–≤–µ–¥—É–≤–∞ –≤–æ –Ý–∞—Å–ø–æ—Ä–µ–¥ 3 –∫–∞–∫–æ –ø–æ—Ç–µ–Ω—Ü–∏—ò–∞–ª–Ω–æ –æ—Ä—É–∂—ò–µ —à—Ç–æ –∏–º–∞ –∏–Ω–¥—É—Å—Ç—Ä–∏—Å–∫–∞ —É–ø–æ—Ç—Ä–µ–±–∞ –æ–¥ –≥–æ–ª–µ–º–∏ —Ä–∞–∑–º–µ—Ä–∏. –ó–µ–º—ò–∏—Ç–µ –ø–æ—Ç–ø–∏—Å–Ω–∏—á–∫–∏ –º–æ—Ä–∞ –¥–∞ –ø—Ä–∏—ò–∞–≤–∞—Ç –ø—Ä–æ–∏–∑–≤–æ–¥—Å—Ç–≤–µ–Ω–∏ –ø–æ–≥–æ–Ω–∏ –∫–æ–∏ –ø—Ä–æ–∏–∑–≤–µ–¥—É–≤–∞–∞—Ç –ø–æ–≤–µ—ú–µ –æ–¥ 30 –º–µ—Ç—Ä–∏—á–∫–∏ —Ç–æ–Ω–∏ –≥–æ–¥–∏—à–Ω–æ –∏ –¥–∞ –¥–æ–∑–≤–æ–ª–∞—Ç –∏–Ω—Å–ø–µ–∫—Ü–∏—ò–∞ –æ–¥ –û—Ä–≥–∞–Ω–∏–∑–∞—Ü–∏—ò–∞—Ç–∞ –∑–∞ –∑–∞–±—Ä–∞–Ω–∞ –Ω–∞ —Ö–µ–º–∏—Å–∫–æ –æ—Ä—É–∂—ò–µ. –ú–æ–∂–µ–±–∏ –Ω–µ–≥–æ–≤–∞—Ç–∞ –Ω–∞—ò–æ–∑–ª–æ–≥–ª–∞—Å–µ–Ω–∞ —É–ø–æ—Ç—Ä–µ–±–∞ –µ Zyklon B (–≥–µ—Ä–º–∞–Ω—Å–∫–∏: –¶–∏–∫–ª–æ–Ω –ë, —Å–æ –ë —à—Ç–æ –∑–Ω–∞—á–∏ Blaus√§ure - –ø—Ä—É—Å–∏–Ω—Å–∫–∞ –∫–∏—Å–µ–ª–∏–Ω–∞; –∏—Å—Ç–æ —Ç–∞–∫–∞, –∑–∞ –¥–∞ —Å–µ —Ä–∞–∑–ª–∏–∫—É–≤–∞ –æ–¥ –ø—Ä–µ—Ç—Ö–æ–¥–Ω–∏–æ—Ç –ø—Ä–æ–∏–∑–≤–æ–¥ –ø–æ–¥–æ—Ü–Ω–∞ –ø–æ–∑–Ω–∞—Ç –∫–∞–∫–æ Zyklon A),[59] –∫–æ—Ä–∏—Å—Ç–µ–Ω –≤–æ –Ω–∞—Ü–∏—Å—Ç–∏—á–∫–∏—Ç–µ –≥–µ—Ä–º–∞–Ω—Å–∫–∏ –ª–æ–≥–æ—Ä–∏ –∑–∞ –∏—Å—Ç—Ä–µ–±—É–≤–∞—ö–µ –∑–∞ –≤—Ä–µ–º–µ –Ω–∞ –í—Ç–æ—Ä–∞—Ç–∞ —Å–≤–µ—Ç—Å–∫–∞ –≤–æ—ò–Ω–∞ –∑–∞ –º–∞—Å–æ–≤–Ω–æ —É–±–∏–≤–∞—ö–µ –∫–∞–∫–æ –¥–µ–ª –æ–¥ –Ω–∏–≤–Ω–∞—Ç–∞ –ø—Ä–æ–≥—Ä–∞–º–∞ –∑–∞ –≥–µ–Ω–æ—Ü–∏–¥ –∑–∞ –∫–æ–Ω–µ—á–Ω–æ —Ä–µ—à–µ–Ω–∏–µ. –¶–∏—ò–∞–Ω–æ–≤–æ–¥–æ—Ä–æ–¥ –∏—Å—Ç–æ —Ç–∞–∫–∞ —Å–µ –∫–æ—Ä–∏—Å—Ç–µ–ª –≤–æ –∫–∞–º–ø–æ–≤–∏—Ç–µ –∑–∞ –∏–∑–ª–∞—á—É–≤–∞—ö–µ –æ–±–ª–µ–∫–∞ –≤–æ –æ–±–∏–¥–∏ –¥–∞ —Å–µ –∏—Å–∫–æ—Ä–µ–Ω–∏ –±–æ–ª–µ—Å—Ç–∏—Ç–µ —à—Ç–æ –≥–∏ –Ω–æ—Å–∞—Ç –≤–æ—à–∫–∏—Ç–µ –∏ –¥—Ä—É–≥–∏—Ç–µ –ø–∞—Ä–∞–∑–∏—Ç–∏. –ï–¥–µ–Ω –æ–¥ –æ—Ä–∏–≥–∏–Ω–∞–ª–Ω–∏—Ç–µ —á–µ—à–∫–∏ –ø—Ä–æ–∏–∑–≤–æ–¥–∏—Ç–µ–ª–∏ –ø—Ä–æ–¥–æ–ª–∂–∏ –¥–∞ –≥–æ –ø—Ä–∞–≤–∏ Zyklon B –ø–æ–¥ —Ç—Ä–≥–æ–≤—Å–∫–∞—Ç–∞ –º–∞—Ä–∫–∞ ‚ÄûUragan D2‚Äú [60] –¥–æ –æ–∫–æ–ª—É 2015 –≥–æ–¥–∏–Ω–∞ [61] –ó–∞ –≤—Ä–µ–º–µ –Ω–∞ –í—Ç–æ—Ä–∞—Ç–∞ —Å–≤–µ—Ç—Å–∫–∞ –≤–æ—ò–Ω–∞, –°–ê–î —Ä–∞–∑–º–∏—Å–ª—É–≤–∞–ª–µ –¥–∞ –≥–æ –∫–æ—Ä–∏—Å—Ç–∞—Ç, –∑–∞–µ–¥–Ω–æ —Å–æ —Ü–∏—ò–∞–Ω–æ–≥–µ–Ω —Ö–ª–æ—Ä–∏–¥, –∫–∞–∫–æ –¥–µ–ª –æ–¥ –û–ø–µ—Ä–∞—Ü–∏—ò–∞—Ç–∞ –î–∞—É–Ω—Ñ–æ–ª, –ø–ª–∞–Ω–∏—Ä–∞–Ω–∞—Ç–∞ –∏–Ω–≤–∞–∑–∏—ò–∞ –Ω–∞ –à–∞–ø–æ–Ω–∏—ò–∞, –Ω–æ –ø—Ä–µ—Ç—Å–µ–¥–∞—Ç–µ–ª–æ—Ç –•–∞—Ä–∏ –¢—Ä—É–º–∞–Ω —Å–µ —Ä–µ—à–∏–ª –ø—Ä–æ—Ç–∏–≤ —Ç–æ–∞, –Ω–∞–º–µ—Å—Ç–æ –¥–∞ –≥–∏ –∫–æ—Ä–∏—Å—Ç–∏ –∞—Ç–æ–º—Å–∫–∏—Ç–µ –±–æ–º–±–∏ —Ä–∞–∑–≤–∏–µ–Ω–∏ –æ–¥ —Ç–∞—ò–Ω–∏–æ—Ç –ø—Ä–æ–µ–∫—Ç –ú–µ–Ω—Ö–µ—Ç–µ–Ω.[62] –¶–∏—ò–∞–Ω–æ–≤–æ–¥–æ—Ä–æ–¥–æ—Ç –∏—Å—Ç–æ —Ç–∞–∫–∞ –±–∏–ª–æ —Å—Ä–µ–¥—Å—Ç–≤–æ—Ç–æ –∫–æ–µ —Å–µ –∫–æ—Ä–∏—Å—Ç–µ–ª–æ –≤–æ —Å—É–¥—Å–∫–∏—Ç–µ –¥–µ—ò—Å—Ç–≤–∏—ò–∞ –≤–æ –Ω–µ–∫–æ–∏ –∞–º–µ—Ä–∏–∫–∞–Ω—Å–∫–∏ –¥—Ä–∂–∞–≤–∏, –∫–∞–¥–µ —à—Ç–æ –±–∏–ª –ø—Ä–æ–∏–∑–≤–µ–¥–µ–Ω –∑–∞ –≤—Ä–µ–º–µ –Ω–∞ –∏–∑–≤—Ä—à—É–≤–∞—ö–µ—Ç–æ —Å–æ –¥–µ—ò—Å—Ç–≤–æ –Ω–∞ —Å—É–ª—Ñ—É—Ä–Ω–∞ –∫–∏—Å–µ–ª–∏–Ω–∞ –Ω–∞ –Ω–∞—Ç—Ä–∏—É–º –∏–ª–∏ –∫–∞–ª–∏—É–º —Ü–∏—ò–∞–Ω–∏–¥.[63] –ü–æ–¥ –∏–º–µ—Ç–æ –ø—Ä—É—Å–∏–Ω—Å–∫–∞ –∫–∏—Å–µ–ª–∏–Ω–∞, HCN —Å–µ –∫–æ—Ä–∏—Å—Ç–µ–ª –∫–∞–∫–æ —É–±–∏—Å—Ç–≤–µ–Ω –∞–≥–µ–Ω—Å –≤–æ —Ö–∞—Ä–ø—É–Ω–∏—Ç–µ –Ω–∞ –∫–∏—Ç–æ–≤–∏, –∏–∞–∫–æ —Å–µ –ø–æ–∫–∞–∂–∞–ª –¥–æ—Å—Ç–∞ –æ–ø–∞—Å–µ–Ω –∑–∞ –µ–∫–∏–ø–∞–∂–æ—Ç —à—Ç–æ –≥–æ —Ä–∞—Å–ø–æ—Ä–µ–¥—É–≤–∞–ª –∏ –±—Ä–∑–æ –±–∏–ª –Ω–∞–ø—É—à—Ç–µ–Ω.[10] –û–¥ —Å—Ä–µ–¥–∏–Ω–∞—Ç–∞ –Ω–∞ 18 –≤–µ–∫ —Å–µ –∫–æ—Ä–∏—Å—Ç–µ–ª –≤–æ –≥–æ–ª–µ–º –±—Ä–æ—ò —É–±–∏—Å—Ç–≤–∞ —Å–æ —Ç—Ä—É–µ—ö–µ –∏ —Å–∞–º–æ—É–±–∏—Å—Ç–≤–∞.[64] –ì–∞—Å–æ—Ç —Ü–∏—ò–∞–Ω–æ–≤–æ–¥–æ—Ä–æ–¥ –≤–æ –≤–æ–∑–¥—É—Ö–æ—Ç –µ –µ–∫—Å–ø–ª–æ–∑–∏–≤–µ–Ω –ø—Ä–∏ –∫–æ–Ω—Ü–µ–Ω—Ç—Ä–∞—Ü–∏–∏ –Ω–∞–¥ 5,6%.[65] –û–≤–∞–∞ –∫–æ–Ω—Ü–µ–Ω—Ç—Ä–∞—Ü–∏—ò–∞ –µ –¥–∞–ª–µ–∫—É –Ω–∞–¥ —Ç–æ–∫—Å–∏—á–Ω–æ—Ç–æ –Ω–∏–≤–æ. –ù–∞–≤–æ–¥–∏
–ù–∞–¥–≤–æ—Ä–µ—à–Ω–∏ –≤—Ä—Å–∫–∏
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia