Ó«ĄÓ»üÓ«ĄÓ»ŹÓ«ĄÓ«ĘÓ«żÓ«Ľ Ó«ĘÓ»łÓ«čÓ»ŹÓ«░Ó»łÓ«čÓ»ü
Ó«çÓ«ęÓ«ÖÓ»ŹÓ«ĽÓ«żÓ«čÓ»ŹÓ«čÓ«┐Ó«ĽÓ«│Ó»Ź
1313-49-1 Y
Ó«¬Ó«úÓ»ŹÓ«¬Ó»üÓ«ĽÓ«│Ó»Ź
Zn3 N2
Ó«ÁÓ«żÓ«»Ó»ŹÓ«¬Ó»ŹÓ«¬Ó«żÓ«čÓ»ŹÓ«čÓ»ü Ó«ÄÓ«čÓ»ł
224.15 Ó«ĽÓ«┐/Ó««Ó»őÓ«▓Ó»Ź[ 1]
Ó«ĄÓ»őÓ«▒Ó»ŹÓ«▒Ó««Ó»Ź
Ó«ÜÓ«żÓ««Ó»ŹÓ«¬Ó«▓Ó»Ź Ó«ĘÓ«┐Ó«▒Ó«ĄÓ»Ź Ó«ĄÓ»éÓ«│Ó»Ź[ 1]
Ó«ůÓ«čÓ«░Ó»ŹÓ«ĄÓ»ŹÓ«ĄÓ«┐
6.22 g/cm┬│, Ó«ĄÓ«┐Ó«úÓ»ŹÓ««Ó««Ó»Ź[ 1]
Ó«ĽÓ«░Ó»łÓ«»Ó«żÓ«ĄÓ»ü (Ó«ÜÓ«┐Ó«ĄÓ»łÓ«ÁÓ«čÓ»łÓ«»Ó»üÓ««Ó»Ź)
Ó«ĽÓ«čÓ»ŹÓ«čÓ««Ó»łÓ«¬Ó»ŹÓ«¬Ó»ü
Ó«¬Ó«čÓ«┐Ó«Ľ Ó«ůÓ««Ó»łÓ«¬Ó»ŹÓ«¬Ó»ü
Ó«ĽÓ«ęÓ«ÜÓ«ĄÓ»üÓ«░Ó««Ó»Ź , cI80
Ó«¬Ó»üÓ«▒Ó«ÁÓ»ćÓ«│Ó«┐Ó«ĄÓ»Ź Ó«ĄÓ»ŐÓ«ĽÓ»üÓ«ĄÓ«┐
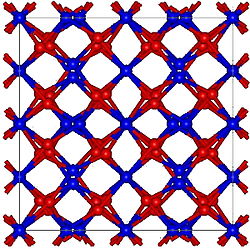
Ia-3, No. 206[ 1] [ 2]
Ó«ĄÓ»ÇÓ«ÖÓ»ŹÓ«ĽÓ»üÓ«ĽÓ«│Ó»Ź
Ó«łÓ«»Ó»é Ó«ÁÓ«ĽÓ»łÓ«¬Ó»ŹÓ«¬Ó«żÓ«čÓ»ü
Ó«¬Ó«čÓ»ŹÓ«čÓ«┐Ó«»Ó«▓Ó«┐Ó«čÓ«¬Ó»ŹÓ«¬Ó«čÓ«ÁÓ«┐Ó«▓Ó»ŹÓ«▓Ó»ł
Ó««Ó«żÓ«▒Ó»üÓ«ĄÓ«▓Ó«żÓ«Ľ Ó«ĆÓ«ĄÓ»üÓ««Ó»Ź Ó«ÜÓ»ŐÓ«▓Ó»ŹÓ«▓Ó«ÁÓ«┐Ó«▓Ó»ŹÓ«▓Ó»ł Ó«ÄÓ«ęÓ»ŹÓ«▒Ó«żÓ«▓Ó»Ź Ó«ĽÓ»ŐÓ«čÓ»üÓ«ĽÓ»ŹÓ«ĽÓ«¬Ó»ŹÓ«¬Ó«čÓ»ŹÓ«č Ó«ĄÓ«░Ó«ÁÓ»üÓ«ĽÓ«│Ó»Ź Ó«»Ó«żÓ«ÁÓ»üÓ««Ó»Ź
Ó«ĄÓ»üÓ«ĄÓ»ŹÓ«ĄÓ«ĘÓ«żÓ«Ľ Ó«ĘÓ»łÓ«čÓ»ŹÓ«░Ó»łÓ«čÓ»ü (Zinc nitride) Ó«ÄÓ«ęÓ»ŹÓ«¬Ó«ĄÓ»ü Zn3 N2 Ó««Ó»éÓ«▓Ó«ĽÓ»ŹÓ«ĽÓ»éÓ«▒Ó»ŹÓ«▒Ó»ü Ó«ÁÓ«żÓ«»Ó»ŹÓ«¬Ó»ŹÓ«¬Ó«żÓ«čÓ»ü Ó«ĽÓ»ŐÓ«úÓ»ŹÓ«č Ó«ĺÓ«░Ó»ü Ó«ĽÓ«ęÓ«┐Ó«« Ó«ÁÓ»çÓ«ĄÓ«┐Ó«»Ó«┐Ó«»Ó«▓Ó»Ź Ó«ÜÓ»çÓ«░Ó»ŹÓ««Ó««Ó«żÓ«ĽÓ»üÓ««Ó»Ź . Ó«ĄÓ»üÓ«ĄÓ»ŹÓ«ĄÓ«ĘÓ«żÓ«ĽÓ««Ó»Ź Ó««Ó«▒Ó»ŹÓ«▒Ó»üÓ««Ó»Ź Ó«ĘÓ»łÓ«čÓ»ŹÓ«░Ó«ÜÓ«ęÓ»Ź Ó«ĄÓ«ęÓ«┐Ó««Ó«ÖÓ»ŹÓ«ĽÓ«│Ó»Ź Ó«ÜÓ»çÓ«░Ó»ŹÓ«ĘÓ»ŹÓ«ĄÓ»ü Ó«çÓ«ÜÓ»ŹÓ«ÜÓ»çÓ«░Ó»ŹÓ««Ó««Ó»Ź Ó«ëÓ«░Ó»üÓ«ÁÓ«żÓ«ĽÓ«┐Ó«▒Ó«ĄÓ»ü. Ó«ĄÓ»éÓ«»Ó»ŹÓ««Ó»łÓ«»Ó«żÓ«ę Ó«ĘÓ«┐Ó«▓Ó»łÓ«»Ó«┐Ó«▓Ó»Ź Ó«çÓ«ÜÓ»ŹÓ«ÜÓ»çÓ«░Ó»ŹÓ««Ó««Ó»Ź Ó«ĽÓ«ęÓ«ÜÓ«ĄÓ»üÓ«░ Ó«ůÓ««Ó»łÓ«¬Ó»ŹÓ«¬Ó«┐Ó«▓Ó»Ź Ó«ĽÓ«żÓ«úÓ«¬Ó»ŹÓ«¬Ó«čÓ»üÓ«ĽÓ«┐Ó«▒Ó«Ą[ 1] [ 2]
Ó«ĽÓ«żÓ«▒Ó»ŹÓ«▒Ó«┐Ó«▓Ó«ż Ó«ÜÓ»éÓ«┤Ó«▓Ó«┐Ó«▓Ó»Ź Ó«ĄÓ»üÓ«ĄÓ»ŹÓ«ĄÓ«ĘÓ«żÓ«ĽÓ««Ó»łÓ«čÓ»ü Ó«ÄÓ«ęÓ»ŹÓ«▒Ó«┤Ó»łÓ«ĽÓ»ŹÓ«ĽÓ«¬Ó»ŹÓ«¬Ó«čÓ»üÓ««Ó»Ź Ó«ĄÓ»üÓ«ĄÓ»ŹÓ«ĄÓ«ĘÓ«żÓ«Ľ Ó«łÓ«░Ó««Ó»ÇÓ«ęÓ»Ź, 200┬░ Ó«ÜÓ»ć Ó«ÁÓ»ćÓ«¬Ó»ŹÓ«¬Ó«ĘÓ«┐Ó«▓Ó»łÓ«»Ó«┐Ó«▓Ó»Ź Ó«ÁÓ»ćÓ«¬Ó»ŹÓ«¬Ó«ÜÓ»Ź Ó«ÜÓ«┐Ó«ĄÓ»łÓ«ÁÓ»ü Ó««Ó»éÓ«▓Ó««Ó«żÓ«Ľ Ó«ĄÓ»üÓ«ĄÓ»ŹÓ«ĄÓ«ĘÓ«żÓ«Ľ Ó«ĘÓ»łÓ«čÓ»ŹÓ«░Ó»łÓ«čÓ«żÓ«Ľ Ó«ëÓ«░Ó»üÓ«ÁÓ«żÓ«ĽÓ«┐Ó«▒Ó«ĄÓ»ü. [ 3] [ 4]
3Zn(NH2 )2 Ôćĺ Zn3 N2 + 4NH3
Ó«ĄÓ»üÓ«ĄÓ»ŹÓ«ĄÓ«ĘÓ«ĽÓ«ĄÓ»ŹÓ«ĄÓ»ł 600┬░ Ó«ÜÓ»ć Ó«ÁÓ»ćÓ«¬Ó»ŹÓ«¬Ó«ĘÓ«┐Ó«▓Ó»łÓ«ĽÓ»ŹÓ«ĽÓ»ü Ó«ůÓ««Ó»őÓ«ęÓ«┐Ó«»Ó«ż Ó«¬Ó«żÓ«»Ó»ŹÓ«ÁÓ«┐Ó«▓Ó»Ź Ó«ÜÓ»éÓ«čÓ»üÓ«¬Ó«čÓ»üÓ«ĄÓ»ŹÓ«ĄÓ«┐Ó«ęÓ«żÓ«▓Ó»üÓ««Ó»Ź Ó«çÓ«ĄÓ»łÓ«ĄÓ»Ź Ó«ĄÓ«»Ó«żÓ«░Ó«┐Ó«ĽÓ»ŹÓ«ĽÓ«▓Ó«żÓ««Ó»Ź.Ó«ÉÓ«ĄÓ«░Ó«ÜÓ«ęÓ»Ź Ó«ÁÓ«żÓ«»Ó»ü Ó«ëÓ«čÓ«ęÓ»Ź Ó«ÁÓ«┐Ó«│Ó»łÓ«¬Ó»ŐÓ«░Ó»üÓ«│Ó«żÓ«Ľ Ó«ëÓ«úÓ»ŹÓ«čÓ«żÓ«ĽÓ«┐Ó«▒Ó«ĄÓ»ü.[ 3] [ 5]
3Zn + 2NH3 Ôćĺ Zn3 N2 + 3H2
Ó«ĄÓ»üÓ«ĄÓ»ŹÓ«ĄÓ«ĘÓ«żÓ«Ľ Ó«ĘÓ»łÓ«čÓ»ŹÓ«░Ó»łÓ«čÓ»ü Ó«ĄÓ«úÓ»ŹÓ«úÓ»ÇÓ«░Ó»üÓ«čÓ«ęÓ»Ź Ó«ĄÓ»ÇÓ«ÁÓ«┐Ó«░Ó««Ó«żÓ«Ľ Ó«ÁÓ«┐Ó«ęÓ»łÓ«¬Ó»üÓ«░Ó«┐Ó«ĘÓ»ŹÓ«ĄÓ»ü Ó«ůÓ««Ó»őÓ«ęÓ«┐Ó«»Ó«ż Ó««Ó«▒Ó»ŹÓ«▒Ó»üÓ««Ó»Ź Ó«ĄÓ»üÓ«ĄÓ»ŹÓ«ĄÓ«ĘÓ«żÓ«Ľ Ó«ćÓ«ĽÓ»ŹÓ«ÜÓ»łÓ«čÓ«żÓ«Ľ Ó«ëÓ«░Ó»üÓ«ÁÓ«żÓ«ĽÓ«┐Ó«▒Ó«Ą[ 3] [ 4]
Zn3 N2 + 3H2 O Ôćĺ 3ZnO + 2NH3
Ó«ĄÓ»üÓ«ĄÓ»ŹÓ«ĄÓ«ĘÓ«żÓ«Ľ Ó«ĘÓ»łÓ«čÓ»ŹÓ«░Ó»łÓ«čÓ»ü, Ó«ÉÓ«ĄÓ«░Ó»ő Ó«ĽÓ»üÓ«│Ó»őÓ«░Ó«┐Ó«ĽÓ»Ź Ó«ůÓ««Ó«┐Ó«▓Ó«ĄÓ»ŹÓ«ĄÓ«┐Ó«▓Ó»Ź [ 6] Ó««Ó«┐Ó«ęÓ»ŹÓ«ÁÓ»çÓ«ĄÓ«┐Ó«»Ó«┐Ó«»Ó«▓Ó»Ź Ó««Ó»üÓ«▒Ó»łÓ«»Ó«┐Ó«▓Ó»Ź Ó««Ó»ÇÓ«│Ó»ŹÓ«ÁÓ«┐Ó«ęÓ»łÓ«»Ó«żÓ«Ľ Ó«çÓ«▓Ó«┐Ó«ĄÓ»ŹÓ«ĄÓ«┐Ó«»Ó«ĄÓ»ŹÓ«ĄÓ»üÓ«čÓ«ęÓ»Ź Ó«ÁÓ«┐Ó«ęÓ»łÓ«¬Ó»üÓ«░Ó«┐Ó«ĽÓ«┐Ó«▒Ó«ĄÓ»ü.[ 7] Ó««Ó«ĽÓ»ŹÓ«ęÓ»ÇÓ«ÜÓ«┐Ó«»Ó««Ó»Ź Ó«ĘÓ»łÓ«čÓ»ŹÓ«░Ó»łÓ«čÓ»ü (Mg3 N2 ) Ó««Ó«▒Ó»ŹÓ«▒Ó»üÓ««Ó»Ź Ó«çÓ«▓Ó«┐Ó«ĄÓ»ŹÓ«ĄÓ«┐Ó«»Ó««Ó»Ź Ó«ĘÓ»łÓ«čÓ»ŹÓ«░Ó»łÓ«čÓ»ü Li3 Ó«ëÓ«░Ó»üÓ«ĽÓ»üÓ«ĘÓ«┐Ó«▓Ó»ł Ó«ĽÓ»ŐÓ«úÓ»ŹÓ«čÓ»üÓ«│Ó»ŹÓ«│Ó«ĄÓ»ü[ 8]
ÔćĹ 1.0 1.1 1.2 1.3 1.4 Sangeeta, D. (1997). Inorganic Materials Chemistry Desk Reference CRC Press . p. 278. ISBN 978-0-8493-8900-9 . Retrieved 2007-09-30 . ÔćĹ 2.0 2.1 Partin, D. E.; Williams, D. J.; O'Keeffe, M. (1997). "The Crystal Structures of Mg3 N2 and Zn3 N2 " . Journal of Solid State Chemistry 132 (1): 56ÔÇô59. doi :10.1006/jssc.1997.7407 . Bibcode: 1997JSSCh.132...56P . http://www.ingentaconnect.com/content/els/00224596/1997/00000132/00000001/art97407 . Ó«¬Ó«żÓ«░Ó»ŹÓ«ĄÓ»ŹÓ«Ą Ó«ĘÓ«żÓ«│Ó»Ź: 2015-11-02 . ÔćĹ 3.0 3.1 3.2 Roscoe, H. E. ; Schorlemmer, C. (1907) [1878]. A Treatise on Chemistry: Volume II, The Metals Macmillan . pp. 650ÔÇô 651. Retrieved 2007-11-01 .ÔćĹ 4.0 4.1 Bloxam, C. L. (1903). Chemistry, Inorganic and Organic . Retrieved 2007-10-31 . ÔćĹ
Lowry, M. T. (1922). Inorganic Chemistry Macmillan . p. 872. Retrieved 2007-11-01 .
ÔćĹ
Comey, A. M.; Hahn, D. A. (1921). A Dictionary of Chemical Solubilities: Inorganic Macmillan . p. 1124. Retrieved 2007-11-01 . {{cite book }}: CS1 maint: multiple names: authors list (link )
ÔćĹ Amatucci, G. G.; Pereira, N. (2004). "Nitride and Silicide Negative Electrodes". In Nazri, G.-A.; Pistoia, G. (ed.). Lithium Batteries: Science and Technology Kluwer Academic Publishers . p. 256. ISBN 978-1-4020-7628-2 . Retrieved 2007-11-01 . {{cite book }}: CS1 maint: multiple names: authors list (link )ÔćĹ Grolier Incorporated (1994). Academic American Encyclopedia ISBN 978-0-7172-2053-3 . Retrieved 2007-11-01 .
Ó«ĄÓ»üÓ«ĄÓ»ŹÓ«ĄÓ«ĘÓ«żÓ«ĽÓ««Ó»Ź (I)
Ó«ĽÓ«░Ó«┐Ó«« Ó«ĄÓ»üÓ«ĄÓ»ŹÓ«ĄÓ«ĘÓ«żÓ«ĽÓ««Ó»Ź (I) Ó«ÜÓ»çÓ«░Ó»ŹÓ««Ó«ÖÓ»ŹÓ«ĽÓ«│Ó»ŹÔÇÄ
Ó«ĄÓ»üÓ«ĄÓ»ŹÓ«ĄÓ«ĘÓ«żÓ«ĽÓ««Ó»Ź (II) Ó«ĽÓ«░Ó«┐Ó«« Ó«ĄÓ»üÓ«ĄÓ»ŹÓ«ĄÓ«ĘÓ«żÓ«ĽÓ««Ó»Ź (II) Ó«ÜÓ»çÓ«░Ó»ŹÓ««Ó«ÖÓ»ŹÓ«ĽÓ«│Ó»ŹÔÇÄ