–•–≤–∞—Ä–æ–±–∞ –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞
–•–≤–∞—Ä–æÃÅ–±–∞ –ê–ª—å—Ü–≥–µÃÅ–π–º–µ—Ä–∞, –∞–±–æ –°–µ–Ω—ñÃÅ–ª—å–Ω–∞—è –¥—ç–º–µÃÅ–Ω—Ü—ã—è –∞–ª—å—Ü–≥–µÃÅ–π–º–µ—Ä–∞—û—Å–∫–∞–≥–∞ —Ç—ãÃÅ–ø—É ‚Äî –Ω–∞–π–±–æ–ª—å—à —Ä–∞—Å–ø–∞—û—Å—é–¥–∂–∞–Ω–∞—è —Ñ–æ—Ä–º–∞ –¥—ç–º–µ–Ω—Ü—ã—ñ, –Ω–µ–π—Ä–∞–¥—ç–≥–µ–Ω–µ—Ä–∞—Ç—ã—û–Ω–∞–µ –∑–∞—Ö–≤–æ—Ä–≤–∞–Ω–Ω–µ, —É–ø–µ—Ä—à—ã–Ω—é –±—ã–ª–æ –∞–ø—ñ—Å–∞–Ω–∞ —û 1906 –≥–æ–¥–∑–µ –Ω—è–º–µ—Ü–∫—ñ–º –ø—Å—ñ—Ö—ñ—è—Ç—Ä–∞–º –ê–ª–æ—ñ—Å–∞–º –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞–º. –Ø–∫ –ø—Ä–∞–≤—ñ–ª–∞, —è–Ω–æ –≤—ã—è—û–ª—è–µ—Ü—Ü–∞ —û –ª—é–¥–∑–µ–π —Å—Ç–∞—Ä—ç–π—à—ã—Ö –∑–∞ 65 –≥–∞–¥–æ—û[3], –∞–ª–µ —ñ—Å–Ω—É–µ —ñ —Ä–∞–Ω–Ω—è—è —Ö–≤–∞—Ä–æ–±–∞ –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ ‚Äî —Ä—ç–¥–∫–∞—è —Ñ–æ—Ä–º–∞ –∑–∞—Ö–≤–æ—Ä–≤–∞–Ω–Ω—è. –ê–≥—É–ª—å–Ω–∞—Å—É—Å–≤–µ—Ç–Ω–∞—è –∑–∞—Ö–≤–æ—Ä–≤–∞–µ–º–∞—Å—Ü—å –Ω–∞ 2006 –≥–æ–¥ –∞—Ü—ç–Ω—å–≤–∞–ª–∞—Å—è —û 26,6 –º–ª–Ω —á–∞–ª–∞–≤–µ–∫, –¥–∞ 2050 –≥–æ–¥–∞ –∫–æ–ª—å–∫–∞—Å—Ü—å —Ö–≤–æ—Ä—ã—Ö –º–æ–∂–∞ –≤—ã—Ä–∞—Å—Ü—ñ —û —á–∞—Ç—ã—Ä—ã —Ä–∞–∑—ã[4]. –£ –∫–æ–∂–Ω–∞–≥–∞ —á–∞–ª–∞–≤–µ–∫–∞ —Ö–≤–∞—Ä–æ–±–∞ –ø—Ä–∞—Ü—è–∫–∞–µ –ø–∞-—Å–≤–æ–π–º—É, –∞–ª–µ –ø—Ä—ã –≥—ç—Ç—ã–º –Ω–∞–∑—ñ—Ä–∞–µ—Ü—Ü–∞ —à—ç—Ä–∞–≥ –∞–≥—É–ª—å–Ω—ã—Ö —Å—ñ–º–ø—Ç–æ–º–∞—û[5]. –ü–µ—Ä—à—ã—è –∑–∞—û–≤–∞–∂–Ω—ã—è –ø—Ä–∞—è–≤—ã –∑–≤—ã—á–∞–π–Ω–∞ –ø–∞–º—ã–ª–∫–æ–≤–∞ –∑–≤—è–∑–≤–∞—é—Ü—å –∑ —Å–∞—Å—Ç–∞—Ä—ç–ª—ã–º —É–∑—Ä–æ—Å—Ç–∞–º –∞–±–æ —Ç–ª—É–º–∞—á–∞—Ü—å —É–ø–ª—ã–≤–∞–º —Å—Ç—Ä—ç—Å—É[6]. –ù–∞–π—á–∞—Å—Ü–µ–π –Ω–∞ —Ä–∞–Ω–Ω—ñ—Ö —Å—Ç–∞–¥—ã—è—Ö –Ω–∞–∑—ñ—Ä–∞–µ—Ü—Ü–∞ —Ä–∞–∑–ª–∞–¥ –∫–∞—Ä–æ—Ç–∫–∞—á–∞—Å–æ–≤–∞–π –ø–∞–º—è—Ü—ñ. –ì—ç—Ç—ã —Å—ñ–º–ø—Ç–æ–º –º–æ–∂–∞ –ø—Ä–∞—è—û–ª—è—Ü—Ü–∞, –Ω–∞–ø—Ä—ã–∫–ª–∞–¥, –Ω—è–∑–¥–æ–ª—å–Ω–∞—Å—Ü—é —û—Å–ø–æ–º–Ω—ñ—Ü—å –Ω—è–¥–∞—û–Ω–∞ –∑–∞–≤—É—á–∞–Ω—É—é —ñ–Ω—Ñ–∞—Ä–º–∞—Ü—ã—é. –ü—Ä—ã –∑–≤—è—Ä—Ç–∞–Ω–Ω—ñ –¥–∞ —û—Ä–∞—á–∞ —ñ –ø–∞–¥–∞–∑—Ä—ç–Ω–Ω—ñ –Ω–∞ —Ö–≤–∞—Ä–æ–±—É –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ –¥–ª—è —û–¥–∞–∫–ª–∞–¥–Ω–µ–Ω–Ω—è –¥—ã—è–≥–Ω–∞–∑—É –∑–≤—ã—á–∞–π–Ω–∞ –∞–Ω–∞–ª—ñ–∑—É—é—Ü—å –ø–∞–≤–æ–¥–∑—ñ–Ω—ã, –ø—Ä–∞–≤–æ–¥–∑—è—Ü—å —Å–µ—Ä—ã—é –∫–∞–≥–Ω—ñ—Ç—ã—û–Ω—ã—Ö —Ç—ç—Å—Ç–∞—û, –∫–∞–ª—ñ –º–∞–≥—á—ã–º–∞, –ø—Ä–∞–≤–æ–¥–∑—ñ—Ü—Ü–∞ –º–∞–≥–Ω—ñ—Ç–Ω–∞-—Ä—ç–∑–∞–Ω–∞–Ω—Å–Ω–∞—è —Ç–∞–º–∞–≥—Ä–∞—Ñ—ñ—è (–ú–Ý–¢)[7]. –ó —Ä–∞–∑–≤—ñ—Ü—Ü—ë–º —Ö–≤–∞—Ä–æ–±—ã –∞–¥–±—ã–≤–∞–µ—Ü—Ü–∞ —Å—Ç—Ä–∞—Ç–∞ –¥–æ—û–≥–∞—á–∞—Å–æ–≤–∞–π –ø–∞–º—è—Ü—ñ[6][8]. –ü–∞—Å—Ç—É–ø–æ–≤–∞—è —Å—Ç—Ä–∞—Ç–∞ —Ñ—É–Ω–∫—Ü—ã–π –∞—Ä–≥–∞–Ω—ñ–∑–º–∞ –≤—è–¥–∑–µ –¥–∞ —Å–º–µ—Ä—Ü—ñ[9]. –Ü–Ω–¥—ã–≤—ñ–¥—É–∞–ª—å–Ω—ã –ø—Ä–∞–≥–Ω–æ–∑ —É—Å–∫–ª–∞–¥–Ω–µ–Ω—ã –ø—Ä–∞–∑ –≤–∞—Ä—ã—è—Ü—ã—ñ —û —Ç—ç—Ä–º—ñ–Ω–µ —Ü—è—á—ç–Ω–Ω—è —Ö–≤–∞—Ä–æ–±—ã, —è–∫–∞—è –º–æ–∂–∞ —Ä–∞–∑–≤—ñ–≤–∞—Ü—Ü–∞ –ø–∞–¥—Å–ø—É–¥–Ω–∞ –Ω–∞ –ø—Ä–∞—Ü—è–≥—É –¥–æ—û–≥–∞–≥–∞ —á–∞—Å—É, –ø–µ—Ä—à —á—ã–º —Å—Ç–∞–Ω—É—Ü—å –∑–∞—û–≤–∞–∂–Ω—ã—è —Å—ñ–º–ø—Ç–æ–º—ã —ñ –±—É–¥–∑–µ –ø–∞—Å—Ç–∞—û–ª–µ–Ω—ã –¥—ã—è–≥–Ω–∞–∑. –°—è—Ä—ç–¥–Ω—è—è –ø—Ä–∞—Ü—è–≥–ª–∞—Å—Ü—å –∂—ã—Ü—Ü—è –ø–∞—Å–ª—è –ø–∞—Å—Ç–∞–Ω–æ—û–∫—ñ –¥—ã—è–≥–Ω–∞–∑—É —Å–∫–ª–∞–¥–∞–µ –∫–∞–ª—è 7 –≥–∞–¥–æ—û[10], –º–µ–Ω—à –∑–∞ 3 % —Ö–≤–æ—Ä—ã—Ö –∂—ã–≤—É—Ü—å –±–æ–ª—å—à –∑–∞ 14 –≥–∞–¥–æ—û[11]. –£ —Å—É—á–∞—Å–Ω–∞—Å—Ü—ñ –Ω–µ –¥–∞—Å—è–≥–Ω—É—Ç–∞ –ø–æ—û–Ω–∞–µ —Ä–∞–∑—É–º–µ–Ω–Ω–µ –ø—Ä—ã—á—ã–Ω —ñ —Ü—è—á—ç–Ω–Ω—è —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞. –î–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω—ñ –¥–∞—é—Ü—å –ø–∞–¥—Å—Ç–∞–≤—ã –º–µ—Ä–∫–∞–≤–∞—Ü—å –∞–± –∞—Å–∞—Ü—ã—è—Ü—ã—ñ —Ö–≤–∞—Ä–æ–±—ã –∑ –Ω–∞–∑–∞–ø–∞—à–≤–∞–Ω–Ω–µ–º –±–ª—è—à–∞–∫ —ñ –Ω–µ–π—Ä–∞—Ñ—ñ–±—Ä—ã–ª—è—Ä–Ω—ã—Ö –∫–ª—É–±–∫–æ—û —É —Ç–∫–∞–Ω–∫–∞—Ö –º–æ–∑–≥–∞. –°—É—á–∞—Å–Ω—ã—è –º–µ—Ç–∞–¥—ã —Ç—ç—Ä–∞–ø—ñ—ñ —Ç–æ–ª—å–∫—ñ –∫—Ä—ã—Ö—É –∑–º—è–≥—á–∞—é—Ü—å —Å—ñ–º–ø—Ç–æ–º—ã, –∞–ª–µ –ø–∞–∫—É–ª—å –Ω–µ –¥–∞–∑–≤–∞–ª—è—é—Ü—å –∞–Ω—ñ —Å–ø—ã–Ω—ñ—Ü—å, –∞–Ω—ñ –∑–∞–ø–∞–≤–æ–ª—ñ—Ü—å —Ä–∞–∑–≤—ñ—Ü—Ü—ë –∑–∞—Ö–≤–æ—Ä–≤–∞–Ω–Ω—è. –ú–Ω–æ—Å—Ç–≤–∞ –ø–µ—Ä—Å–ø–µ–∫—Ç—ã—û–Ω—ã—Ö –º–µ—Ç–∞–¥–∞—û —Ç—ç—Ä–∞–ø—ñ—ñ –¥–∞—Å—è–≥–Ω—É–ª—ñ —ç—Ç–∞–ø—É –∫–ª—ñ–Ω—ñ—á–Ω—ã—Ö –≤—ã–ø—Ä–∞–±–∞–≤–∞–Ω–Ω—è—û, –∫–æ–ª—å–∫–∞—Å—Ü—å —è–∫—ñ—Ö –Ω–∞ 2008 –≥–æ–¥ —Å–∫–ª–∞–¥–∞–ª–∞ –±–æ–ª—å—à –∑–∞ 500, –∞–ª–µ –Ω—è—è—Å–Ω–∞, —Ü—ñ –±—É–¥–∑–µ –¥–∞–∫–∞–∑–∞–Ω–∞ —ñ—Ö —ç—Ñ–µ–∫—Ç—ã—û–Ω–∞—Å—Ü—å. –£ 2013 –≥–æ–¥–∑–µ –º–µ—Ç–∞–¥ –≥–ª—ã–±–æ–∫–∞–π —Ç—Ä–∞–Ω—Å–∫—Ä–∞–Ω—ñ—è–ª—å–Ω–∞–π –º–∞–≥–Ω—ñ—Ç–Ω–∞–π —Å—Ç—ã–º—É–ª—è—Ü—ã—ñ (Deep TMS) –∞—Ç—Ä—ã–º–∞—û –∑–Ω–∞–∫ –∞–¥–∞–±—Ä—ç–Ω–Ω—è ¬´CE Mark¬ª –¥–ª—è –ª—è—á—ç–Ω–Ω—è —è–∫ —Å—ñ–º–ø—Ç–æ–º–∞—û —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞, –≥—ç—Ç–∞–∫ —ñ —ñ–Ω—à—ã—Ö –∑–∞—Ö–≤–æ—Ä–≤–∞–Ω–Ω—è—û[12][13]. –î–∑–≤–µ –∞–º–µ—Ä—ã–∫–∞–Ω—Å–∫—ñ—è –∫–∞–º–ø–∞–Ω—ñ—ñ —Å–ø—ã–Ω—ñ–ª—ñ —Ä–∞—Å–ø—Ä–∞—Ü–æ—û–∫—É –∫–æ–ª—ñ—à–Ω—è–≥–∞ –ø–µ—Ä—Å–ø–µ–∫—Ç—ã—û–Ω–∞–≥–∞ –ø—Ä—ç–ø–∞—Ä–∞—Ç–∞ –¥–ª—è –ø–∞–ª—è–≥—á—ç–Ω–Ω—è –Ω–∞—Å—Ç—É–ø—Å—Ç–≤–∞—û —Å—Ç—Ä–∞—Ç—ã –ø–∞–º—è—Ü—ñ –ø—Ä—ã —Ö–≤–∞—Ä–æ–±–µ –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ –ø–∞—Å–ª—è –¥–≤—É—Ö –∫–ª—ñ–Ω—ñ—á–Ω—ã—Ö –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω—è—û, –ø–∞–¥—á–∞—Å —è–∫—ñ—Ö —Å—Ä–æ–¥–∞–∫ –Ω–µ –∑–º–æ–≥ –¥–∞–ø–∞–º–∞–≥—á—ã —Ö–≤–æ—Ä—ã–º. –î–∞—Å–ª–µ–¥—á—ã–∫—ñ –ø–∞–≤–µ–¥–∞–º—ñ–ª—ñ, —à—Ç–æ —Å—Ç–∞–Ω–æ—û—á–∞—è –¥—ã–Ω–∞–º—ñ–∫–∞ –∑–∞—Ö–≤–æ—Ä–≤–∞–Ω–Ω—è —û –ø–∞—Ü—ã–µ–Ω—Ç–∞—û —É –ª—ë–≥–∫–∞–π –∞–±–æ —Ä–∞–Ω–Ω—è–π —Å—Ç–∞–¥—ã—ñ —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ –Ω–µ –∞–¥—Ä–æ–∑–Ω—ñ–≤–∞–ª–∞—Å—è –∞–¥ –≥—ç—Ç–∞–∫–∞–π —É –∫–∞–Ω—Ç—Ä–æ–ª—å–Ω–∞–π –≥—Ä—É–ø–µ –ø–∞—Ü—ã–µ–Ω—Ç–∞—û, —è–∫—ñ–º –¥–∞–≤–∞–ª—ñ –ø–ª–∞—Ü—ç–±–∞. –ö–∞–º–ø–∞–Ω—ñ—ñ ¬´Pfizer¬ª —ñ ¬´Johnson&Johnson¬ª –∑–∞—è–≤—ñ–ª—ñ, —à—Ç–æ —û—Å–µ —ñ–Ω—à—ã—è –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω—ñ —û –≥—ç—Ç–∞–π –≥–∞–ª—ñ–Ω–µ –±—ã–ª—ñ —Å–ø—ã–Ω–µ–Ω—ã. –£ –¥–∞–¥–∑–µ–Ω—ã –º–æ–º–∞–Ω—Ç —ç—Ñ–µ–∫—Ç—ã—û–Ω—ã—Ö –ª–µ–∫–∞—û –∞–¥ —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ –Ω–µ —ñ—Å–Ω—É–µ[14]. –ü—Ä–∞–ø–∞–Ω–æ—û–≤–∞–µ—Ü—Ü–∞ –º–Ω–æ—Å—Ç–≤–∞ —Å–ø–æ—Å–∞–±–∞—û –ø–∞–ø—è—Ä—ç–¥–∑—ñ—Ü—å —Ö–≤–∞—Ä–æ–±—É –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞, –∞–ª–µ –Ω–µ –±—ã—û –∞–¥–∑–Ω–∞—á–∞–Ω—ã —ñ—Ö —É–ø–ª—ã—û –Ω–∞ —Ü—è—á—ç–Ω–Ω–µ –∑–∞—Ö–≤–æ—Ä–≤–∞–Ω–Ω—è —ñ —è–≥–æ —Ü—è–∂–∫–∞—Å—Ü—å. –Ø–∫ –¥–ª—è –ø—Ä–∞—Ñ—ñ–ª–∞–∫—Ç—ã–∫—ñ, –≥—ç—Ç–∞–∫ —ñ –¥–ª—è –±–∞—Ä–∞—Ü—å–±—ã –∑ —Ö–≤–∞—Ä–æ–±–∞–π —á–∞—Å—Ç–∞ —Ä—ç–∫–∞–º–µ–Ω–¥—É—é—Ü—å –∑–∞–π–º–∞—Ü—Ü–∞ —Ñ—ñ–∑—ñ—á–Ω—ã–º—ñ –ø—Ä–∞–∫—Ç—ã–∫–∞–≤–∞–Ω–Ω—è–º—ñ, —Å—Ç—ã–º—É–ª—è–≤–∞—Ü—å –º—ã—Å–ª–µ–Ω–Ω–µ —ñ –ø—Ä—ã—Ç—Ä—ã–º–ª—ñ–≤–∞—Ü—Ü–∞ –∑–±–∞–ª–∞–Ω—Å–∞–≤–∞–Ω–∞–π –¥—ã–µ—Ç—ã[15]. –•–≤–∞—Ä–æ–±–∞ –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ –∞–¥–Ω–æ—Å—ñ—Ü—Ü–∞ –¥–∞ –∑–∞—Ö–≤–æ—Ä–≤–∞–Ω–Ω—è—û, —è–∫—ñ—è –Ω–∞–∫–ª–∞–¥–≤–∞—é—Ü—å –Ω–∞–π–±–æ–ª—å—à —Ü—è–∂–∫—ñ —Ñ—ñ–Ω–∞–Ω—Å–∞–≤—ã —Ü—è–∂–∞—Ä –Ω–∞ –≥—Ä–∞–º–∞–¥—Å—Ç–≤–∞ —û —Ä–∞–∑–≤—ñ—Ç—ã—Ö –∫—Ä–∞—ñ–Ω–∞—Ö[16][17]. –ì—ñ—Å—Ç–æ—Ä—ã—è –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω—è –£—Ä–∞—á—ã —ñ —Ñ—ñ–ª–æ—Å–∞—Ñ—ã –°—Ç–∞—Ä–∞–∂—ã—Ç–Ω—ã—Ö –ì—Ä—ç—Ü—ã—ñ —ñ –Ý—ã–º–∞ –∑–≤—è–∑–≤–∞–ª—ñ —Å—Ç–∞—Ä–∞—Å—Ü—å –∑ –∞—Å–ª–∞–±–ª–µ–Ω–Ω–µ–º —Ä–æ–∑—É–º—É, –∞–¥–Ω–∞–∫ —Ç–æ–ª—å–∫—ñ —û 1901 –≥. –Ω—è–º–µ—Ü–∫—ñ –ø—Å—ñ—Ö—ñ—è—Ç—Ä –ê–ª–æ—ñ—Å –ê–ª—å—Ü–≥–µ–π–º–µ—Ä –∞–¥–∑–Ω–∞—á—ã—û –≤—ã–ø–∞–¥–∞–∫ —Ö–≤–∞—Ä–æ–±—ã, —è–∫–∞—è —û –±—É–¥—É—á—ã–Ω—ñ –±—ã–ª–∞ –Ω–∞–∑–≤–∞–Ω–∞ —û —è–≥–æ –≥–æ–Ω–∞—Ä. –ê–Ω–∞–ª—ñ–∑ –∑–∞—Ö–≤–æ—Ä–≤–∞–Ω–Ω—è –ø—è—Ü—ñ–¥–∑–µ—Å—è—Ü—ñ–≥–∞–¥–æ–≤–∞–π –ê—û–≥—É—Å—Ç—ã –î—ç—Ç—ç—Ä —ë–Ω –∞–ø—É–±–ª—ñ–∫–∞–≤–∞—û —É–ø–µ—Ä—à—ã–Ω—é —û 1906 –≥., –ø–∞—Å–ª—è —Ç–∞–≥–æ —è–∫ –ø–∞—Ü—ã–µ–Ω—Ç–∫–∞, –∑–∞ —è–∫–æ–π —ë–Ω –Ω–∞–∑—ñ—Ä–∞—û, –ø–∞–º–µ—Ä–ª–∞[18][19][20]. –ù–∞ –ø—Ä–∞—Ü—è–≥—É –Ω–∞—Å—Ç—É–ø–Ω—ã—Ö –ø—è—Ü—ñ –≥–∞–¥–æ—û —É –º–µ–¥—ã—Ü—ã–Ω—Å–∫–∞–π –ª—ñ—Ç–∞—Ä–∞—Ç—É—Ä—ã –∑‚Äô—è–≤—ñ–ª—ñ—Å—è —è—à—á—ç 11 –ø–∞–¥–æ–±–Ω—ã—Ö –∞–ø—ñ—Å–∞–Ω–Ω—è—û, –ø—Ä—ã—á—ã–º –Ω–µ–∫–∞—Ç–æ—Ä—ã—è –∑ —ñ—Ö —É–∂–æ –≤—ã–∫–∞—Ä—ã—Å—Ç–æ—û–≤–∞–ª—ñ —Ç—ç—Ä–º—ñ–Ω ¬´—Ö–≤–∞—Ä–æ–±–∞ –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞¬ª[21]. –≠–º—ñ–ª—å –ö—Ä—ç–ø–µ–ª—ñ–Ω –±—ã—û –ø–µ—Ä—à—ã–º, —Ö—Ç–æ –Ω–∞–∑–≤–∞—û —Ö–≤–∞—Ä–æ–±—É –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ —Å–∞–º–∞—Å—Ç–æ–π–Ω—ã–º –∑–∞—Ö–≤–æ—Ä–≤–∞–Ω–Ω–µ–º. –£ 1910 –≥–æ–¥–∑–µ —ë–Ω –≤—ã–ª—É—á—ã—û —è–µ —û —è–∫–∞—Å—Ü—ñ –ø–∞–¥—Ç—ã–ø—É —Å–µ–Ω—ñ–ª—å–Ω–∞–π –¥—ç–º–µ–Ω—Ü—ã—ñ —û –≤–æ—Å—å–º—ã–º –≤—ã–¥–∞–Ω–Ω—ñ —Å–≤–∞–π–≥–æ –ø–∞–¥—Ä—É—á–Ω—ñ–∫–∞ –ø–∞ –ø—Å—ñ—Ö—ñ—è—Ç—Ä—ã—ñ, –Ω–∞–¥–∞—û—à—ã —ë–π –ø–∞—Ä–∞–ª–µ–ª—å–Ω—É—é –Ω–∞–∑–≤—É ¬´–ø—Ä—ç—Å–µ–Ω—ñ–ª—å–Ω–∞—è –¥—ç–º–µ–Ω—Ü—ã—謪[22]. –î—ã—è–≥–Ω–∞–∑ —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ –Ω–∞ –ø—Ä–∞—Ü—è–≥—É –±–æ–ª—å—à–∞–π —á–∞—Å—Ç–∫—ñ XX —Å—Ç. —Å—Ç–∞–≤—ñ–ª—ñ —Ç–æ–ª—å–∫—ñ –∞–¥–Ω–æ—Å–Ω–∞ –º–∞–ª–∞–¥—ã–º –ø–∞—Ü—ã–µ–Ω—Ç–∞–º, —É —è–∫—ñ—Ö –ø–µ—Ä—à—ã—è —Å—ñ–º–ø—Ç–æ–º—ã –¥—ç–º–µ–Ω—Ü—ã—ñ –≤—ã—è—û–ª—è–ª—ñ—Å—è –≤–∞ —û–∑—Ä–æ—Å—Ü–µ –∞–¥ 45 –¥–∞ 65 –≥–∞–¥–æ—û. –¢—ç—Ä–º—ñ–Ω–∞–ª–æ–≥—ñ—è –∑–º—è–Ω—ñ–ª–∞—Å—è –ø–∞—Å–ª—è –ø—Ä–∞–≤–µ–¥–∑–µ–Ω–∞–π —É 1977 –≥–æ–¥–∑–µ –∫–∞–Ω—Ñ–µ—Ä—ç–Ω—Ü—ã—ñ –ø–∞ —Ö–≤–∞—Ä–æ–±–µ –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞, —É–¥–∑–µ–ª—å–Ω—ñ–∫—ñ —è–∫–æ–π –ø—Ä—ã–π—à–ª—ñ –¥–∞ –≤—ã—Å–Ω–æ–≤—ã, —à—Ç–æ –∫–ª—ñ–Ω—ñ—á–Ω—ã—è —ñ –ø–∞—Ç–∞–ª–∞–≥—ñ—á–Ω—ã—è –ø—Ä–∞—è–≤—ã –ø—Ä—ç—Å–µ–Ω—ñ–ª—å–Ω–∞–π —ñ —Å–µ–Ω—ñ–ª—å–Ω–∞–π –¥—ç–º–µ–Ω—Ü—ã–π –ø—Ä–∞–∫—Ç—ã—á–Ω–∞ —ñ–¥—ç–Ω—Ç—ã—á–Ω—ã—è, —Ö–∞—Ü—è —ñ –Ω–µ –≤—ã–∫–ª—é—á—ã–ª—ñ —ñ—Å–Ω–∞–≤–∞–Ω–Ω—è —ç—Ç—ã—è–ª–∞–≥—ñ—á–Ω—ã—Ö –∞–¥—Ä–æ–∑–Ω–µ–Ω–Ω—è—û[23]. –ü–∞—Å—Ç—É–ø–æ–≤–∞ –¥—ã—è–≥–Ω–∞–∑ –ø–∞—á–∞–ª—ñ —Å—Ç–∞–≤—ñ—Ü—å –Ω–µ–∑–∞–ª–µ–∂–Ω–∞ –∞–¥ —É–∑—Ä–æ—Å—Ç—É[24], —Ö–∞—Ü—è –ø—ç—û–Ω—ã —á–∞—Å –¥–ª—è –∞–ø—ñ—Å–∞–Ω–Ω—è —Ö–≤–∞—Ä–æ–±—ã —û –∞—Å–æ–± —Å—Ç–∞—Ä—ç–π—à—ã—Ö –∑–∞ 65 –≥–∞–¥–æ—û —É—Å—ë —è—à—á—ç –≤—ã–∫–∞—Ä—ã—Å—Ç–æ—û–≤–∞–ª—ñ —Ç—ç—Ä–º—ñ–Ω ¬´—Å–µ–Ω—ñ–ª—å–Ω–∞—è –¥—ç–º–µ–Ω—Ü—ã—è –∞–ª—å—Ü–≥–µ–π–º–µ—Ä–∞—û—Å–∫–∞–≥–∞ —Ç—ã–ø—ɬª (SDAT), –∑–∞—Ö–æ—û–≤–∞—é—á—ã ¬´–∫–ª–∞—Å—ñ—á–Ω—ã¬ª –¥—ã—è–≥–Ω–∞–∑ —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ –¥–ª—è –±–æ–ª—å—à –º–∞–ª–∞–¥—ã—Ö. –£ –≤—ã–Ω—ñ–∫—É —Ç—ç—Ä–º—ñ–Ω ¬´—Ö–≤–∞—Ä–æ–±–∞ –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞¬ª –±—ã—û —Ñ–∞—Ä–º–∞–ª—å–Ω–∞ –ø—Ä—ã–Ω—è—Ç—ã —û –º–µ–¥—ã—Ü—ã–Ω—Å–∫—É—é –Ω–∞–º–µ–Ω–∫–ª–∞—Ç—É—Ä—É —è–∫ –Ω–∞–∑–≤–∞ –∑–∞—Ö–≤–æ—Ä–≤–∞–Ω–Ω—è, —è–∫–æ–µ –¥—ã—è–≥–Ω–∞—Å—Ç—É–µ—Ü—Ü–∞ –Ω–µ–∑–∞–ª–µ–∂–Ω–∞ –∞–¥ —É–∑—Ä–æ—Å—Ç—É –ø—Ä—ã –Ω–∞—è—û–Ω–∞—Å—Ü—ñ –∞–¥–ø–∞–≤–µ–¥–Ω—ã—Ö —Å—ñ–º–ø—Ç–æ–º–∞—û, —è–∫—ñ—è —Ä–∞–∑–≤—ñ–≤–∞—é—Ü—Ü–∞ —Ö–∞—Ä–∞–∫—Ç—ç—Ä–Ω—ã–º —á—ã–Ω–∞–º —ñ —Å—É–ø—Ä–∞–≤–∞–¥–∂–∞—é—Ü—Ü–∞ –∑‚Äô—è—û–ª–µ–Ω–Ω–µ–º —Ç—ã–ø–æ–≤—ã—Ö –Ω–µ–π—Ä–∞–ø–∞—Ç–∞–ª–∞–≥—ñ—á–Ω—ã—Ö –ø—Ä—ã–∫–º–µ—Ç[25]. –≠–ø—ñ–¥—ç–º—ñ—è–ª–æ–≥—ñ—è –Ω—è–º–∞ –¥–∞–¥–∑–µ–Ω—ã—Ö ‚⧠50 50‚Äì70 70‚Äì90 90‚Äì110 110‚Äì130 130‚Äì150 150‚Äì170 170‚Äì190 190‚Äì210 210‚Äì230 230‚Äì250 ‚â• 250
–î–≤–∞ –∞—Å–Ω–æ—û–Ω—ã—è –ø–∞–∫–∞–∑—á—ã–∫—ñ, —è–∫—ñ—è –≤—ã–∫–∞—Ä—ã—Å—Ç–æ—û–≤–∞—é—Ü—Ü–∞ —û —ç–ø—ñ–¥—ç–º—ñ—è–ª–∞–≥—ñ—á–Ω—ã—Ö –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω—è—Ö ‚Äî –∑–∞—Ö–≤–æ—Ä–≤–∞–µ–º–∞—Å—Ü—å —ñ —Ä–∞—Å–ø–∞—û—Å—é–¥–∂–∞–Ω–∞—Å—Ü—å –∑–∞—Ö–≤–æ—Ä–≤–∞–Ω–Ω—è. –ó–∞—Ö–≤–æ—Ä–≤–∞–µ–º–∞—Å—Ü—å –∞–¥–ª—é—Å—Ç—Ä–æ—û–≤–∞–µ –∫–æ–ª—å–∫–∞—Å—Ü—å –Ω–æ–≤—ã—Ö –≤—ã–ø–∞–¥–∫–∞—û –Ω–∞ –∞–¥–∑—ñ–Ω–∫—É —á–∞–ª–∞–≤–µ–∫–∞-—á–∞—Å—É (–∑–≤—ã—á–∞–π–Ω–∞ –∫–æ–ª—å–∫–∞—Å—Ü—å –Ω–æ–≤—ã—Ö –≤—ã–ø–∞–¥–∫–∞—û –Ω–∞ —Ç—ã—Å—è—á—É —á–∞–ª–∞–≤–µ–∫–∞-–≥–∞–¥–æ—û), –∞ —Ä–∞—Å–ø–∞—û—Å—é–¥–∂–∞–Ω–∞—Å—Ü—å –∑–∞—Ö–≤–æ—Ä–≤–∞–Ω–Ω—è –¥–∞–∑–≤–∞–ª—è–µ –º–µ—Ä–∫–∞–≤–∞—Ü—å –∞–± –∞–≥—É–ª—å–Ω–∞–π –∫–æ–ª—å–∫–∞—Å—Ü—ñ –ø–∞–∫—É—Ç—É—é—á—ã—Ö –Ω–∞ —Ö–≤–∞—Ä–æ–±—É —û –ø–∞–ø—É–ª—è—Ü—ã—ñ —û –∫–∞–Ω–∫—Ä—ç—Ç–Ω—ã –º–æ–º–∞–Ω—Ç —á–∞—Å—É. –ö–∞–≥–æ—Ä—Ç–Ω—ã—è –ª–∞–Ω–≥—ñ—Ü—é–¥–Ω—ã—è –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω—ñ (–ø–∞–¥—á–∞—Å —è–∫—ñ—Ö –ø–µ—Ä—à–∞–ø–∞—á–∞—Ç–∫–æ–≤–∞ –∑–¥–∞—Ä–æ–≤–∞—è –ø–∞–ø—É–ª—è—Ü—ã—è –∞–¥—Å–æ—á–≤–∞–µ—Ü—Ü–∞ –Ω–∞ –ø—Ä–∞—Ü—è–≥—É –º–Ω–æ–≥—ñ—Ö –≥–∞–¥–æ—û) –¥–∞–∑–≤–∞–ª—è—é—Ü—å –º–µ—Ä–∫–∞–≤–∞—Ü—å –∞–± –∑–∞—Ö–≤–æ—Ä–≤–∞–µ–º–∞—Å—Ü—ñ –Ω–∞ —û–∑—Ä–æ—û–Ω—ñ 10-15 –Ω–æ–≤—ã—Ö –≤—ã–ø–∞–¥–∫–∞—û –Ω–∞ —Ç—ã—Å—è—á—É —á–∞–ª–∞–≤–µ–∫–∞-–≥–∞–¥–æ—û –¥–ª—è —û—Å—ñ—Ö —Ç—ã–ø–∞—û –¥—ç–º–µ–Ω—Ü—ã—ñ —ñ 5-8 –≤—ã–ø–∞–¥–∫–∞—û –¥–ª—è —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞[26][27], —à—Ç–æ —Å–∫–ª–∞–¥–∞–µ –ø—Ä—ã–∫–ª–∞–¥–Ω–∞ –ø–∞–ª–æ–≤—É –∞–¥ –∞–≥—É–ª—å–Ω–∞–π –∫–æ–ª—å–∫–∞—Å—Ü—ñ —à—Ç–æ–≥–∞–¥–æ–≤—ã—Ö –¥—ã—è–≥–Ω–∞–∑–∞—û. –°–∞—Å—Ç–∞—Ä—ç–ª—ã —û–∑—Ä–æ—Å—Ç –∑‚Äô—è—û–ª—è–µ—Ü—Ü–∞ –≥–∞–ª–æ—û–Ω—ã–º —Ñ–∞–∫—Ç–∞—Ä–∞–º —Ä—ã–∑—ã–∫—ñ, —à—Ç–æ –∞–¥–ª—é—Å—Ç—Ä–æ—û–≤–∞–µ—Ü—Ü–∞ —û —Å—Ç–∞—Ç—ã—Å—Ç—ã—Ü—ã: –Ω–∞ –∫–æ–∂–Ω—ã—è 5 –≥–∞–¥–æ—û –ø–∞—Å–ª—è 65-–≥–∞–¥–æ–≤–∞–≥–∞ —û–∑—Ä–æ—Å—Ç—É –ø–∞–∫–∞–∑—á—ã–∫ —Ä—ã–∑—ã–∫—ñ –ø–∞–≤—è–ª—ñ—á–≤–∞–µ—Ü—Ü–∞ –ø—Ä—ã–∫–ª–∞–¥–Ω–∞ —û –¥–≤–∞ —Ä–∞–∑—ã, –≤—ã—Ä–∞—Å—Ç–∞—é—á—ã –∞–¥ 3 –≤—ã–ø–∞–¥–∫–∞—û —É 65 –≥–∞–¥–æ—û –¥–∞ 69 –≤—ã–ø–∞–¥–∫–∞—û –Ω–∞ —Ç—ã—Å—è—á—É —á–∞–ª–∞–≤–µ–∫–∞-–≥–∞–¥–æ—û –∫ 95 –≥–∞–¥–∞–º[26][27]. –Ü—Å–Ω—É—é—Ü—å —ñ –ø–∞–ª–∞–≤—ã—è –∞–¥—Ä–æ–∑–Ω–µ–Ω–Ω—ñ: –∂–∞–Ω—á—ã–Ω—ã —á–∞—Å—Ü–µ–π –∑–∞—Ö–≤–æ—Ä–≤–∞—é—Ü—å –Ω–∞ —Ö–≤–∞—Ä–æ–±—É –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞, –∞—Å–∞–±–ª—ñ–≤–∞ –ø–∞—Å–ª—è 85 –≥–∞–¥–æ—û[27][28]. –Ý–∞—Å–ø–∞—û—Å—é–¥–∂–∞–Ω–∞—Å—Ü—å —Ö–≤–∞—Ä–æ–±—ã —û –ø–∞–ø—É–ª—è—Ü—ã—ñ –∑–∞–ª–µ–∂—ã—Ü—å –∞–¥ —Ä–æ–∑–Ω—ã—Ö —Ñ–∞–∫—Ç–∞—Ä–∞—û, —É —Ç—ã–º –ª—ñ–∫—É –∞–¥ –∑–∞—Ö–≤–æ—Ä–≤–∞–µ–º–∞—Å—Ü—ñ —ñ —Å–º—è—Ä–æ—Ç–Ω–∞—Å—Ü—ñ. –ü–∞–∫–æ–ª—å–∫—ñ –∑–∞—Ö–≤–æ—Ä–≤–∞–µ–º–∞—Å—Ü—å —Ä–∞—Å—Ü–µ –∑ —É–∑—Ä–æ—Å—Ç–∞–º, –Ω–µ–∞–±—Ö–æ–¥–Ω–∞ –∑–∞—û–∂–¥—ã —û–ª—ñ—á–≤–∞—Ü—å —Å—è—Ä—ç–¥–Ω—ñ —û–∑—Ä–æ—Å—Ç –Ω–∞—Å–µ–ª—å–Ω—ñ—Ü—Ç–≤–∞ —û –º—è—Å—Ü–æ–≤–∞—Å—Ü—ñ, –¥–∑–µ –ø—Ä–∞–≤–æ–¥–∑—è—Ü—Ü–∞ –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω—ñ. –£ –ó–®–ê –ø–∞ —Å—Ç–∞–Ω–µ –Ω–∞ 2000 –≥. –∫–∞–ª—è 1,6 % –Ω–∞—Å–µ–ª—å–Ω—ñ—Ü—Ç–≤–∞, —è–∫ —É —Ü—ç–ª—ã–º, –≥—ç—Ç–∞–∫ —ñ —û –≥—Ä—É–ø–µ 65-74 –≥–∞–¥–æ—û, –º–µ–ª—ñ —Ö–≤–∞—Ä–æ–±—É –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞. –£ –≥—Ä—É–ø–µ 75-84 –≥–∞–¥–æ—û –≥—ç—Ç—ã –ø–∞–∫–∞–∑—á—ã–∫ —Å–∫–ª–∞–¥–∞—û —É–∂–æ 19 %, –∞ —Å—è—Ä–æ–¥ –≥—Ä–∞–º–∞–¥–∑—è–Ω, —á—ã–π —É–∑—Ä–æ—Å—Ç –ø–µ—Ä–∞–≤—ã—Å—ñ—û 84 –≥–∞–¥—ã, —Ä–∞—Å–ø–∞—û—Å—é–¥–∂–∞–Ω–∞—Å—Ü—å —Ö–≤–∞—Ä–æ–±—ã —Å–∫–ª–∞–¥–∞–ª–∞ 42 %[29][30]. –£ –º–µ–Ω—à —Ä–∞–∑–≤—ñ—Ç—ã—Ö –∫—Ä–∞—ñ–Ω–∞—Ö —Ä–∞—Å–ø–∞—û—Å—é–¥–∂–∞–Ω–∞—Å—Ü—å —Ö–≤–∞—Ä–æ–±—ã –Ω—ñ–∂—ç–π—à–∞—è[31]. –ü–∞ –¥–∞–¥–∑–µ–Ω—ã—Ö –°–ê–ê–ó, —É 2005 –≥. –Ω–∞ –¥—ç–º–µ–Ω—Ü—ã—é —Ö–≤–∞—Ä—ç–ª—ñ 0,379 % —Å—É—Å–≤–µ—Ç–Ω–∞–≥–∞ –Ω–∞—Å–µ–ª—å–Ω—ñ—Ü—Ç–≤–∞, –∞ –ø—Ä–∞–≥–Ω–æ–∑ –Ω–∞ 2015 –≥. –¥–∞—Å—è–≥–∞—û –∑–Ω–∞—á—ç–Ω–Ω—è 0,441 %, –ø—Ä—ã –≥—ç—Ç—ã–º –ø—Ä–∞–≥–Ω–æ–∑ –Ω–∞ 2030 –≥. —Å–∫–ª–∞–¥–∞—û 0,556 %[32]. –î–∞ –ø–∞–¥–æ–±–Ω—ã—Ö –≤—ã—Å–Ω–æ—û –ø—Ä—ã—Ö–æ–¥–∑—è—Ü—å —ñ –∞—û—Ç–∞—Ä—ã —ñ–Ω—à—ã—Ö –ø—Ä–∞—Ü[31]. –Ø—à—á—ç –∞–¥–Ω–æ –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω–µ –¥–∞–∑–≤–∞–ª—è–µ –º–µ—Ä–∫–∞–≤–∞—Ü—å –∞–± —Ç—ã–º, —à—Ç–æ —É 2006 –≥. —Ä–∞—Å–ø–∞—û—Å—é–¥–∂–∞–Ω–∞—Å—Ü—å —Ö–≤–∞—Ä–æ–±—ã —û —Å–≤–µ—Ü–µ —Å–∫–ª–∞–¥–∞–ª–∞ 0,40 % (—ñ–Ω—Ç—ç—Ä–≤–∞–ª 0,17 % ‚Äî 0,89 %, –∞–±—Å–∞–ª—é—Ç–Ω–∞—è –∫–æ–ª—å–∫–∞—Å—Ü—å ‚Äî 26,6 –º–ª–Ω —á–∞–ª–∞–≤–µ–∫, –∑ —ñ–Ω—Ç—ç—Ä–≤–∞–ª–∞–º 11,4‚Äî59,4 –º–ª–Ω) —ñ –ø—Ä–∞–¥–∫–∞–∑–≤–∞–µ, —à—Ç–æ –¥–æ–ª–µ–≤—ã –ø–∞–∫–∞–∑—á—ã–∫ –≤—ã—Ä–∞—Å—Ü–µ —û –¥–≤–∞ —Ä–∞–∑—ã, –∞ –∞–±—Å–∞–ª—é—Ç–Ω–∞—è –∫–æ–ª—å–∫–∞—Å—Ü—å —Ö–≤–æ—Ä—ã—Ö ‚Äî —É —á–∞—Ç—ã—Ä—ã —Ä–∞–∑—ã –¥–∞ 2050 –≥.[4][33] –≠—Ç—ã—è–ª–æ–≥—ñ—è–ü—Ä—ã—á—ã–Ω—ã –±–æ–ª—å—à–∞—Å—Ü—ñ –≤—ã–ø–∞–¥–∫–∞—û —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ –¥–∞ –≥—ç—Ç–∞–≥–∞ —á–∞—Å—É –Ω–µ–≤—è–¥–æ–º—ã—è, –∞–∫—Ä–∞–º—è 1 % ‚Äî 5 % –≤—ã–ø–∞–¥–∫–∞—û, –∫–∞–ª—ñ –≥–µ–Ω–µ—Ç—ã—á–Ω—ã—è –∞—Å–∞–±–ª—ñ–≤–∞—Å—Ü—ñ –±—ã–ª—ñ –≤—ã—è—û–ª–µ–Ω—ã[34]. –ù–µ–∫–∞–ª—å–∫—ñ –∫–∞–Ω–∫—É—Ä—ã—Ä—É—é—á—ã—Ö –≥—ñ–ø–æ—Ç—ç–∑ —Å–ø—Ä–∞–±—É—é—Ü—å —Ä–∞—Å—Ç–ª—É–º–∞—á—ã—Ü—å —ç—Ç—ã—è–ª–æ–≥—ñ—é —Ö–≤–∞—Ä–æ–±—ã. –ì–µ–Ω–µ—Ç—ã—á–Ω–∞—è –≥—ñ–ø–æ—Ç—ç–∑–∞–ì–µ–Ω–µ—Ç—ã—á–Ω–∞—è –≥—ñ–ø–æ—Ç—ç–∑–∞ —û–∑–Ω—ñ–∫–Ω–µ–Ω–Ω—è —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ (–∞—Å–∞–±–ª—ñ–≤–∞ –ø–∞—Ä—É—à—ç–Ω–Ω—è –ø–∞–º—è—Ü—ñ) –±–∞–∑—ñ—Ä—É–µ—Ü—Ü–∞ –Ω–∞ –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω—è—Ö –±–ª—ñ–∑–Ω—è—Ç —ñ —Å—è–º–µ–π–Ω—ã—Ö –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω—è—Ö. –ë—ã–ª–æ –≤—ã—Å–≤–µ—Ç–ª–µ–Ω–∞, —à—Ç–æ —ñ–º–∞–≤–µ—Ä–Ω–∞—Å—Ü—å –∞—Ç—Ä—ã–º–∞—Ü—å —Ö–≤–∞—Ä–æ–±—É —û —Å–ø–∞–¥—á—ã–Ω—É –ª—è–∂—ã—Ü—å —É –¥—ã—è–ø–∞–∑–æ–Ω–µ –∞–¥ 49 % –¥–∞ 79 %[35][36]. –ü—Ä—ã–∫–ª–∞–¥–Ω–∞ 0,1 % –≤—ã–ø–∞–¥–∫–∞—û —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ —Å–∫–ª–∞–¥–∞—é—Ü—å —Å—è–º–µ–π–Ω—ã—è —Ñ–æ—Ä–º—ã, —è–∫—ñ—è –ø–µ—Ä–∞–¥–∞—é—Ü—Ü–∞ –ø–∞ –∞—û—Ç–∞—Å–æ–º–Ω–∞-–¥–∞–º—ñ–Ω–∞–Ω—Ç–Ω—ã–º —Ç—ã–ø–µ —ñ –ø—Ä–∞—è—û–ª—è—é—Ü—Ü–∞ –¥–∞ 65 –≥–∞–¥–æ—û[37]. –ì—ç—Ç–∞ —Ñ–æ—Ä–º–∞ —Ö–≤–∞—Ä–æ–±—ã –≤—è–¥–æ–º–∞—è –ø–∞–¥ –Ω–∞–∑–≤–∞–π ¬´—Ä–∞–Ω–Ω—è—è —Å—è–º–µ–π–Ω–∞—è —Ñ–æ—Ä–º–∞ —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞¬ª. –ë–æ–ª—å—à–∞—Å—Ü—å –≤—ã–ø–∞–¥–∫–∞—û –≥—ç—Ç–∞–π —Ñ–æ—Ä–º—ã —Ä–∞–∑–≤—ñ–≤–∞—é—Ü—Ü–∞ –ø—Ä–∞–∑ –º—É—Ç–∞—Ü—ã—ñ —û –∞–¥–Ω—ã–º –∑ —Ç—Ä–æ—Ö –≥–µ–Ω–∞—û: —É —Ç—ã–º, —à—Ç–æ –∫–∞–¥–∑—ñ—Ä—É–µ –ø–∞–ø—è—Ä—ç–¥–Ω—ñ–∫ –±—ç—Ç–∞-–∞–º—ñ–ª–æ—ñ–¥—É (–ü–ë–ê), –∞–±–æ —û –≥–µ–Ω–∞—Ö, —à—Ç–æ –∫–∞–¥–∑—ñ—Ä—É—é—Ü—å —Å—ñ–Ω—Ç—ç–∑ –ø—Ä—ç—Å–µ–Ω—ñ–ª—ñ–Ω–∞—û 1 —ñ 2[38]. –ë–æ–ª—å—à–∞—Å—Ü—å –º—É—Ç–∞—Ü—ã–π —É –≥–µ–Ω–∞—Ö, –∞–¥–∫–∞–∑–Ω—ã—Ö –∑–∞ –ü–ë–ê —ñ –ø—Ä—ç—Å–µ–Ω—ñ–ª—ñ–Ω—ã, –≤—è–¥—É—Ü—å –¥–∞ –ø–∞–≤–µ–ª—ñ—á—ç–Ω–Ω—è –ø—Ä–∞–¥—É–∫—Ü—ã—ñ –º–∞–ª–µ–Ω—å–∫—ñ—Ö –±—è–ª–∫–æ—û –∑ –Ω–∞–∑–≤–∞–π AŒ≤42, —è–∫—ñ –∑‚Äô—è—û–ª—è–µ—Ü—Ü–∞ –≥–∞–ª–æ—û–Ω—ã–º –∫–∞–º–ø–∞–Ω–µ–Ω—Ç–∞–º —Å–µ–Ω—ñ–ª—å–Ω—ã—Ö –±–ª—è—à–∞–∫[39]. –ù–µ–∫–∞—Ç–æ—Ä—ã—è –∂–∞ –º—É—Ç–∞—Ü—ã—ñ —Ç–æ–ª—å–∫—ñ –∑–º—è–Ω—è—é—Ü—å —Å—É–∞–¥–Ω–æ—Å—ñ–Ω—ã –ø–∞–º—ñ–∂ AŒ≤42 —ñ —ñ–Ω—à—ã–º—ñ –±—É–π–Ω–µ–π—à—ã–º—ñ —Ñ–æ—Ä–º–∞–º—ñ (–Ω–∞–ø—Ä—ã–∫–ª–∞–¥, AŒ≤40) –±–µ–∑ –ø–∞–≤–µ–ª—ñ—á—ç–Ω–Ω—è —û–∑—Ä–æ—û–Ω—é AŒ≤42[40][41]. –ì—ç—Ç–∞ —Å–≤–µ–¥—á—ã—Ü—å –∞–± —Ç—ã–º, —à—Ç–æ –º—É—Ç–∞—Ü—ã—ñ, –∑–≤—è–∑–∞–Ω—ã—è –∑ –ø—Ä—ç—Å–µ–Ω—ñ–ª—ñ–Ω–∞–º—ñ, –º–æ–≥—É—Ü—å –≤—ã–∫–ª—ñ–∫–∞—Ü—å —Ö–≤–∞—Ä–æ–±—É, –Ω–∞–≤–∞—Ç –∫–∞–ª—ñ —è–Ω—ã –∑–Ω—ñ–∂–∞—é—Ü—å –∞–≥—É–ª—å–Ω—É—é –∫–æ–ª—å–∫–∞—Å—Ü—å –ø—Ä–∞–¥—É–∫—Ü—ã—ñ AŒ≤, —ñ –º–æ–∂–∞ –ø—Ä—ã–≤–µ—Å—Ü—ñ –¥–∞ –∞–¥–∫—Ä—ã—Ü—Ü—è —ñ–Ω—à—ã—Ö —Ä–æ–ª—è—û –ø—Ä—ç—Å–µ–Ω—ñ–ª—ñ–Ω–∞—û –∞–±–æ —û–∑–∞–µ–º–∞–¥–∑–µ—è–Ω–Ω—è –ø–∞–º—ñ–∂ –ü–ë–ê —ñ AŒ≤. –Ü—Å–Ω—É—é—Ü—å —Ç–∞–∫—Å–∞–º–∞ –ø—Ä–∞—Ç—ç–∫—Ü—ã–π–Ω—ã—è –≤–∞—Ä—ã—è–Ω—Ç—ã –≥–µ–Ω–∞—û —Å—ñ–Ω—Ç—ç–∑—É –ü–ë–ê[42]. –ë–æ–ª—å—à–∞—Å—Ü—å –≤—ã–ø–∞–¥–∫–∞—û —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ –Ω–µ –º–∞—é—Ü—å –∞—û—Ç–∞—Å–æ–º–Ω–∞-–¥–∞–º—ñ–Ω–∞–Ω—Ç–Ω–∞–≥–∞ –º–µ—Ö–∞–Ω—ñ–∑–º—É –≤–µ—Ä—Ç—ã–∫–∞–ª—å–Ω–∞–π –ø–µ—Ä–∞–¥–∞—á—ã —ñ –Ω–∞–∑—ã–≤–∞—é—Ü—Ü–∞ ¬´—Å–ø–∞—Ä–∞–¥—ã—á–Ω–∞—è —Ö–≤–∞—Ä–æ–±–∞ –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞¬ª, —É —è–∫–æ–π —Ñ–∞–∫—Ç–∞—Ä—ã –Ω–∞–≤–∞–∫–æ–ª—å–Ω–∞–≥–∞ –∞—Å—è—Ä–æ–¥–¥–∑—è —ñ –≥–µ–Ω–µ—Ç—ã—á–Ω—ã—è –∞–¥—Ä–æ–∑–Ω–µ–Ω–Ω—ñ –º–æ–≥—É—Ü—å —ñ–≥—Ä–∞—Ü—å —Ä–æ–ª—é —Ñ–∞–∫—Ç–∞—Ä–∞—û —Ä—ã–∑—ã–∫—ñ. –ù–∞–π–±–æ–ª—å—à –≤—è–¥–æ–º—ã–º –≥–µ–Ω–µ—Ç—ã—á–Ω—ã–º —Ñ–∞–∫—Ç–∞—Ä–∞–º —Ä—ã–∑—ã–∫—ñ –∑‚Äô—è—û–ª—è–µ—Ü—Ü–∞ –Ω–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω–µ –∞–ª–µ–ª—è Œµ4 –∞–ø–∞–ª—ñ–ø–∞–ø—Ä–∞—Ç—ç—ñ–Ω—É E (–ê–ü–êE)[43][44]. –ê–¥ 40 % –¥–∞ 80 % –ª—é–¥–∑–µ–π –∑ —Ö–≤–∞—Ä–æ–±–∞–π –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ –º–∞—é—Ü—å –ø—Ä—ã–Ω–∞–º—Å—ñ –∞–¥–∑—ñ–Ω –∞–ª–µ–ª—å –ê–ü–ê–4[44]. –ê–ü–ê–4 –∞–ª–µ–ª—å –ø–∞–≤—è–ª—ñ—á–≤–∞–µ —Ä—ã–∑—ã–∫—É —Ö–≤–∞—Ä–æ–±—ã —û 3 —Ä–∞–∑—ã —û –≥–µ—Ç—ç—Ä–∞–∑—ñ–≥–æ—Ç —ñ —û 15 —Ä–∞–∑–æ—û —É –≥–æ–º–∞–∑—ñ–≥–æ—Ç[37]. –Ø–∫ —ñ —û –≤—ã–ø–∞–¥–∫–∞—Ö –∑ –º–Ω–æ–≥—ñ–º—ñ —ñ–Ω—à—ã–º—ñ –∑–∞—Ö–≤–æ—Ä–≤–∞–Ω–Ω—è–º—ñ —á–∞–ª–∞–≤–µ–∫–∞, —ç—Ñ–µ–∫—Ç—ã –Ω–∞–≤–∞–∫–æ–ª—å–Ω–∞–≥–∞ –∞—Å—è—Ä–æ–¥–¥–∑—è —ñ –≥–µ–Ω–µ—Ç—ã—á–Ω—ã—è –º–∞–¥—ã—Ñ—ñ–∫–∞—Ç–∞—Ä—ã –≤—ã—è—û–ª—è—é—Ü—Ü–∞ —û –Ω—è–ø–æ—û–Ω–∞–π –ø–µ–Ω–µ—Ç—Ä–∞–Ω—Ç–Ω–∞—Å—Ü—ñ. –ù–∞–ø—Ä—ã–∫–ª–∞–¥, –Ω–µ–∫–∞—Ç–æ—Ä—ã—è –Ω—ñ–≥–µ—Ä—ã–π—Å–∫—ñ—è –ø–∞–ø—É–ª—è—Ü—ã—ñ –Ω–µ –º–∞—é—Ü—å —Å—É–∞–¥–Ω–æ—Å—ñ–Ω –ø–∞–º—ñ–∂ –¥–æ–∑–∞–π –ê–ü–ê–4 —ñ –≤—ã–ø–∞–¥–∫–∞–º—ñ —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞, —à—Ç–æ, –∞–¥–Ω–∞–∫, –Ω–∞–∑—ñ—Ä–∞–µ—Ü—Ü–∞ –≤–∞ —û—Å—ñ—Ö —ñ–Ω—à—ã—Ö –ª—é–¥—Å–∫—ñ—Ö –ø–∞–ø—É–ª—è—Ü—ã—è—Ö[45][46]. –ü–µ—Ä—à—ã—è —Å–ø—Ä–æ–±—ã –ø—Ä–∞–≤–µ—Å—Ü—ñ —Å–∫—Ä—ã–Ω—ñ–Ω–≥ 400 –≥–µ–Ω–∞—û, —è–∫—ñ—è, –º–∞–≥—á—ã–º–∞, –º–∞–≥–ª—ñ –±—ã –∫–∞–¥–∑—ñ—Ä–∞–≤–∞—Ü—å –ø–æ–∑–Ω—é—é —Ñ–æ—Ä–º—É —Å–ø–∞—Ä–∞–¥—ã—á–Ω–∞–π —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ (–ü–§–•–ê), –Ω–µ –ø—Ä—ã–Ω–µ—Å–ª—ñ –ø–ª—ë–Ω—É[37][38]. –ü–∞–∑–Ω–µ–π—à—ã—è –ø–æ—û–Ω–∞–≥–µ–Ω–æ–º–Ω—ã—è –ø–æ—à—É–∫—ñ –∞—Å–∞—Ü—ã—è—Ü—ã–π (–ü–ü–ê) –∑–Ω–∞–π—à–ª—ñ 19 –∑–æ–Ω —É –≥–µ–Ω–∞—Ö, —è–∫—ñ—è, —ñ–º–∞–≤–µ—Ä–Ω–∞, –ø–∞–≤—è–ª—ñ—á–≤–∞—é—Ü—å —Ä—ã–∑—ã–∫—É —Ö–≤–∞—Ä–æ–±—ã[47]. –ì—ç—Ç–∞ –Ω–∞—Å—Ç—É–ø–Ω—ã—è –≥–µ–Ω—ã: CASS4, CELF1, FERMT2, HLA-DRB5, INPP5D, MEF2C, NME8, PTK2B, SORL1, ZCWPW1, SIC24A4, CLU, PICALM, CR1, BIN1, MS4A, ABCA7, EPHA1 —ñ CD2AP[47]. –ú—É—Ç–∞—Ü—ã—ñ —û –≥–µ–Ω–µ TREM2 –∞—Å–∞—Ü—ã—é—é—Ü—Ü–∞ –∑ –ø–∞–≤–µ–ª—ñ—á—ç–Ω–Ω–µ–º —Ä—ã–∑—ã–∫—ñ —Ä–∞–∑–≤—ñ—Ü—Ü—è —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ —û 3-5 —Ä–∞–∑–æ—û[48][49]. –ú–µ—Ä–∫–∞–≤–∞–Ω—ã –º–µ—Ö–∞–Ω—ñ–∑–º –¥–∑–µ—è–Ω–Ω—è –º—É—Ü—ñ—Ä–∞–≤–∞—û—à–∞–≥–∞ –≥–µ–Ω–∞ —û —Ç—ã–º, —à—Ç–æ –ª–µ–π–∫–∞—Ü—ã—Ç—ã —û –≥–∞–ª–∞—û–Ω—ã–º –º–æ–∑–≥—É –≥—É–±–ª—è—é—Ü—å –∑–¥–æ–ª—å–Ω–∞—Å—Ü—å –∫–∞–Ω—Ç—Ä–∞–ª—è–≤–∞—Ü—å –∫–æ–ª—å–∫–∞—Å—Ü—å –ø—Ä—ã—Å—É—Ç–Ω–∞—Å—Ü—ñ –±—ç—Ç–∞-–∞–º—ñ–ª–æ—ñ–¥—É. –•–∞–ª—ñ–Ω–µ—Ä–≥—ñ—á–Ω–∞—è –≥—ñ–ø–æ—Ç—ç–∑–∞–ù–∞–π—Å—Ç–∞—Ä—ç–π—à–∞–π –≥—ñ–ø–æ—Ç—ç–∑–∞–π, –Ω–∞ —è–∫–æ–π –±–∞–∑—ñ—Ä—É–µ—Ü—Ü–∞ –±–æ–ª—å—à–∞—Å—Ü—å —Å—É—á–∞—Å–Ω—ã—Ö —Å—Ç—Ä–∞—Ç—ç–≥—ñ–π –ª–µ–∫–∞–≤–∞–π —Ç—ç—Ä–∞–ø—ñ—ñ, –∑‚Äô—è—û–ª—è–µ—Ü—Ü–∞ —Ö–∞–ª—ñ–Ω–µ—Ä–≥—ñ—á–Ω–∞—è[50], —Å—É—Ç–Ω–∞—Å—Ü—å —è–∫–æ–π —É —Ç—ã–º, —à—Ç–æ —Ä–∞–∑–≤—ñ—Ü—Ü—ë —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ –∑–≤—è–∑–≤–∞—é—Ü—å —Å–∞ –∑–º—è–Ω—à—ç–Ω–Ω–µ–º —Å—ñ–Ω—Ç—ç–∑—É –Ω–µ–π—Ä–∞—Ç—Ä–∞–Ω—Å–º—ñ—Ç–∞—Ä–∞ –∞—Ü—ç—Ç—ã–ª—Ö–∞–ª—ñ–Ω—É. –•–∞–ª—ñ–Ω–µ—Ä–≥—ñ—á–Ω–∞—è –≥—ñ–ø–æ—Ç—ç–∑–∞ –Ω–µ –∑–∞—Å–ª—É–∂—ã–ª–∞ —à—ã—Ä–æ–∫–∞–π –ø–∞–¥—Ç—Ä—ã–º–∫—ñ –ø–µ—Ä–∞–≤–∞–∂–Ω–∞ —Ç–∞–º—É, —à—Ç–æ –ª–µ–∫—ñ, —è–∫—ñ—è –ª–µ—á–∞—Ü—å –¥—ç—Ñ—ñ—Ü—ã—Ç –∞—Ü—ç—Ç—ã–ª—Ö–∞–ª—ñ–Ω—É, –Ω–µ –ø—Ä—ã–Ω–µ—Å–ª—ñ –ø–ª—ë–Ω—É. –ú–µ—Ä–∫–∞–≤–∞–ª–∞—Å—è —Ç–∞–∫—Å–∞–º–∞ –Ω–∞—è—û–Ω–∞—Å—Ü—å —ñ–Ω—à—ã—Ö —Ö–∞–ª—ñ–Ω–µ—Ä–≥—ñ—á–Ω—ã—Ö —ç—Ñ–µ–∫—Ç–∞—û: –Ω–∞–ø—Ä—ã–∫–ª–∞–¥, —ñ–Ω—ñ—Ü—ã—è—Ü—ã—è –º–∞—Å—ñ—û–Ω–∞–π –∞–≥—Ä—ç–≥–∞—Ü—ã—ñ –∞–º—ñ–ª–æ—ñ–¥—É[51], —è–∫–∞—è –≤—è–¥–∑–µ –¥–∞ –≥–µ–Ω–µ—Ä–∞–ª—ñ–∑–∞–≤–∞–Ω–∞–≥–∞ –Ω–µ–π—Ä–∞–∑–∞–ø–∞–ª–µ–Ω–Ω—è[52]. –ê–º—ñ–ª–æ—ñ–¥–Ω–∞—è –≥—ñ–ø–æ—Ç—ç–∑–∞–£ 1991 –≥. –±—ã–ª–∞ —Ä–∞—Å–ø—Ä–∞—Ü–∞–≤–∞–Ω–∞ –∞–º—ñ–ª–æ—ñ–¥–Ω–∞—è –≥—ñ–ø–æ—Ç—ç–∑–∞, —è–∫–∞—è —Å—Ü–≤—è—Ä–¥–∂–∞–ª–∞, —à—Ç–æ –ø–∞–∑–∞–∫–ª–µ—Ç–∞—á–Ω—ã—è –Ω–∞–∑–∞–ø–∞—à–≤–∞–Ω–Ω—ñ –±—ç—Ç–∞-–∞–º—ñ–ª–æ—ñ–¥—É (AŒ≤) –∑‚Äô—è—û–ª—è—é—Ü—Ü–∞ —Ñ—É–Ω–¥–∞–º–µ–Ω—Ç–∞–ª—å–Ω–∞–π –ø—Ä—ã—á—ã–Ω–∞–π —Ö–≤–∞—Ä–æ–±—ã[53][54]. –ì—ç—Ç–∞ –≥—ñ–ø–æ—Ç—ç–∑–∞ –ø–∞–¥—Ç—Ä—ã–º–ª—ñ–≤–∞–ª–∞—Å—è —Ç—ã–º, —à—Ç–æ –≥–µ–Ω, —è–∫—ñ –∫–∞–¥–∑—ñ—Ä—É–µ –ø–∞–ø—è—Ä—ç–¥–Ω—ñ–∫ –±—ç—Ç–∞-–∞–º—ñ–ª–æ—ñ–¥—É (–ü–ë–ê), –∑–Ω–∞—Ö–æ–¥–∑—ñ—Ü—Ü–∞ —û 21-–π —Ö—Ä–∞–º–∞—Å–æ–º–µ, –∞ –ª—é–¥–∑—ñ –∑ —Ç—Ä—ã—Å–∞–º—ñ—è–π –ø–∞ 21-–π —Ö—Ä–∞–º–∞—Å–æ–º–µ (—Å—ñ–Ω–¥—Ä–æ–º –î–∞—û–Ω–∞), –º–∞—é—á—ã –ª—ñ—à–Ω—é—é 21-—é —Ö—Ä–∞–º–∞—Å–æ–º—É, –∞–º–∞–ª—å –∑–∞—û—Å—ë–¥—ã –∑–∞—Ö–≤–æ—Ä–≤–∞–ª—ñ –Ω–∞ —Ö–≤–∞—Ä–æ–±—É –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ –∫ 40 –≥–∞–¥–∞–º[55][56]. –¢–∞–∫—Å–∞–º–∞ –ê–ü–ê–ï4, —Å–ø–µ—Ü—ã—Ñ—ñ—á–Ω–∞—è —ñ–∑–∞—Ñ–æ—Ä–º–∞ –∞–ø–∞–ª—ñ–ø–∞–ø—Ä–∞—Ç—ç—ñ–Ω—É, –∑‚Äô—è—û–ª—è–µ—Ü—Ü–∞ –≤—è–ª—ñ–∫—ñ–º –≥–µ–Ω–µ—Ç—ã—á–Ω—ã–º —Ñ–∞–∫—Ç–∞—Ä–∞–º —Ä—ã–∑—ã–∫—ñ –¥–ª—è —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞. –£ —Ç–æ–π —á–∞—Å, –∫–∞–ª—ñ –∞–ø–∞–ª—ñ–ø–∞–ø—Ä–∞—Ç—ç—ñ–Ω—ã –ø–∞–≤—è–ª—ñ—á–≤–∞—é—Ü—å —Ä–∞–∑–±—É—Ä—ç–Ω–Ω–µ –±—ç—Ç–∞-–∞–º—ñ–ª–æ—ñ–¥—É, –Ω–µ–∫–∞—Ç–æ—Ä—ã—è —ñ—Ö —ñ–∑–∞—Ñ–æ—Ä–º—ã –Ω–µ–¥–∞—Å—Ç–∞—Ç–∫–æ–≤–∞ —ç—Ñ–µ–∫—Ç—ã—û–Ω—ã—è (—è–∫ –ê–ü–ê–ï4), —à—Ç–æ –≤—è–¥–∑–µ –¥–∞ –Ω–∞–∑–∞–ø–∞—à–≤–∞–Ω–Ω—è –∞–º—ñ–ª–æ—ñ–¥—É —û –º–æ–∑–≥—É[57]. –î–∞–ª–µ–π—à—ã—è –¥–æ–∫–∞–∑—ã –±—ã–ª—ñ –∞—Ç—Ä—ã–º–∞–Ω—ã –ø—Ä–∞–∑ —Ç–æ–µ, —à—Ç–æ —Ç—Ä–∞–Ω—Å–≥–µ–Ω–Ω—ã—è –º—ã—à—ã, —è–∫—ñ—è —ç–∫—Å–ø—Ä—ç—Å—ñ—Ä–∞–≤–∞–ª—ñ –º—É—Ç–∞–Ω—Ç–Ω—É—é —Ñ–æ—Ä–º—É —á–∞–ª–∞–≤–µ—á–∞–≥–∞ –ü–ë–ê, —Ä–∞–∑–≤—ñ–≤–∞–ª—ñ —Ñ—ñ–±—Ä—ã–ª—è—Ä–Ω—ã—è –∞–º—ñ–ª–æ—ñ–¥–Ω—ã—è –±–ª—è—à–∫—ñ —ñ –ø–∞—Ç–∞–ª–æ–≥—ñ—é –º–æ–∑–≥–∞, –ø–∞–¥–æ–±–Ω—É—é –¥–∞ —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞, –ø—Ä—ã —è–∫–æ–π –Ω–∞ –ø–µ—Ä—à–∞–µ –º–µ—Å—Ü–∞ –≤—ã—Ö–æ–¥–∑—ñ–ª—ñ –¥—ç—Ñ–µ–∫—Ç—ã –ø—Ä–∞—Å—Ç–æ—Ä–∞–≤–∞–≥–∞ –Ω–∞–≤—É—á–∞–Ω–Ω—è[58][59][60][61]. –ë—ã–ª–∞ —Ä–∞—Å–ø—Ä–∞—Ü–∞–≤–∞–Ω–∞ —ç–∫—Å–ø–µ—Ä—ã–º–µ–Ω—Ç–∞–ª—å–Ω–∞—è –≤–∞–∫—Ü—ã–Ω–∞, —è–∫–∞—è –¥–∞–∑–≤–∞–ª—è–ª–∞ ¬´—á—ã—Å—Ü—ñ—ܗ嬪 –∞–º—ñ–ª–æ—ñ–¥–Ω—ã—è –±–ª—è—à–∫—ñ —û –ø–µ—Ä—à—ã—Ö –≤—ã–ø—Ä–∞–±–∞–≤–∞–Ω–Ω—è—Ö –Ω–∞ –ª—é–¥–∑—è—Ö, –∞–¥–Ω–∞–∫ —è–Ω–∞ –Ω–µ –∞–∫–∞–∑–∞–ª–∞ –Ω—ñ—è–∫–∞–≥–∞ –∑–Ω–∞—á–Ω–∞–≥–∞ —ç—Ñ–µ–∫—Ç—É –Ω–∞ –¥—ç–º–µ–Ω—Ü—ã—é[62]. –î–∞—Å–ª–µ–¥—á—ã–∫—ñ –º–µ—Ä–∫–∞–≤–∞–ª—ñ, —à—Ç–æ –ø–∞–∑–∞–±–ª—è—à–∞—á–Ω—ã—è –∞–ª—ñ–≥–∞–º–µ—Ä—ã AŒ≤ –∑‚Äô—è—û–ª—è—é—Ü—Ü–∞ –ø–∞—Ç–∞–ª–∞–≥—ñ—á–Ω—ã–º —Å—É–±—Å—Ç—Ä–∞—Ç–∞–º –¥–ª—è —Ä–∞–∑–≤—ñ—Ü—Ü—è –ø–∞—Ç–∞–ª–æ–≥—ñ—ñ. –ì—ç—Ç—ã—è —Ç–∞–∫—Å—ñ—á–Ω—ã—è –∞–ª—ñ–≥–∞–º–µ—Ä—ã, –≤—è–¥–æ–º—ã—è —Ç–∞–∫—Å–∞–º–∞ –ø–∞–¥ –Ω–∞–∑–≤–∞–π –∞–º—ñ–ª–æ—ñ–¥-–∞—Ç—Ä—ã–º–∞–Ω—ã—è –¥—ã—Ñ—É–Ω–¥–∑—ñ—Ä—É—é—á—ã—è –ª—ñ–≥–∞–Ω–¥—ã (–ê–ê–î–õ), –∑–≤—è–∑–≤–∞—é—Ü—Ü–∞ –∑ –ø–∞–≤–µ—Ä—Ö–Ω—è–π —Ä—ç—Ü—ç–ø—Ç–∞—Ä–∞ –Ω–∞ –Ω–µ–π—Ä–æ–Ω–µ —ñ –∑–º—è–Ω—è—é—Ü—å —Å—Ç—Ä—É–∫—Ç—É—Ä—É —Å—ñ–Ω–∞–ø—Å–∞, –ø–∞—Ä—É—à–∞—é—á—ã —Ç–∞–∫—ñ–º —á—ã–Ω–∞–º –Ω–µ–π—Ä–∞–Ω–∞–ª—å–Ω—É—é –∫–∞–º—É–Ω—ñ–∫–∞—Ü—ã—é[63]. –£ —Ä–æ–ª—ñ —Å—ñ–≥–Ω–∞–ª—å–Ω–∞–π –º–∞–ª–µ–∫—É–ª—ã –∞–ª—ñ–≥–∞–º–µ—Ä—ã AŒ≤ –Ω–∞–≥–∞–¥–≤–∞—é—Ü—å –ø–∞ —Å—Ç—Ä—É–∫—Ç—É—Ä—ã –ø—Ä—ã—ë–Ω–∞–≤—ã—è –±—è–ª–∫—ñ, —è–∫—ñ—è –≤—ã–∫–ª—ñ–∫–∞—é—Ü—å –≥—É–±—á–∞—Ç—É—é —ç–Ω—Ü—ç—Ñ–∞–ª–∞–ø–∞—Ç—ã—é –±—É–π–Ω–æ–≥–∞ —Ä–∞–≥–∞—Ç–∞–≥–∞ –±—ã–¥–ª–∞, –∞ —Ç–∞–∫—Å–∞–º–∞ —Ö–≤–∞—Ä–æ–±—É –ö—Ä–æ–π—Ü—Ñ–µ–ª—å—Ç–∞ ‚Äî –Ø–∫–∞–±–∞ (–∞–Ω–∞–ª–∞–≥—ñ—á–Ω–∞–µ —á–∞–ª–∞–≤–µ—á–∞–µ –∑–∞—Ö–≤–æ—Ä–≤–∞–Ω–Ω–µ), –ø—Ä—ã—á—ã–º –º–µ—Ö–∞–Ω—ñ–∑–º –Ω–µ–π—Ä–∞–¥—ç–≥–µ–Ω–µ—Ä–∞—Ü—ã—ñ –ø—Ä—ã –≤—ã—à—ç–π –∑–≥–∞–¥–∞–Ω—ã—Ö –∑–∞—Ö–≤–æ—Ä–≤–∞–Ω–Ω—è—Ö –Ω–∞–≥–∞–¥–≤–∞–µ –≥—ç—Ç–∞–∫—ñ –ø—Ä—ã —Ö–≤–∞—Ä–æ–±–µ –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞[64]. –£ 2009 –≥–æ–¥–∑–µ –≥—ç—Ç–∞ —Ç—ç–æ—Ä—ã—è –±—ã–ª–∞ –¥–∞–ø–æ—û–Ω–µ–Ω–∞ –∑–¥–∞–≥–∞–¥–∫–∞–π, —à—Ç–æ –Ω–µ —Ç–æ–ª—å–∫—ñ –Ω–µ–ø–∞—Å—Ä—ç–¥–Ω–∞ —Å–∞–º –±—ç—Ç–∞-–∞–º—ñ–ª–æ—ñ–¥, –∞–ª–µ —ñ —è–≥–æ –±–ª—ñ–∑–∫—ñ ¬´—Å–≤–∞—è–∫¬ª (–±—ç—Ç–∞-–∞–º—ñ–ª–æ—ñ–¥–∞–ø–∞–¥–æ–±–Ω—ã –±—è–ª–æ–∫) –º–æ–∂–∞ –±—ã—Ü—å –≤—ñ–Ω–∞–≤–∞—Ç—ã —û —Ä–∞–∑–≤—ñ—Ü—Ü—ñ —Ö–≤–∞—Ä–æ–±—ã. –¢—ç–æ—Ä—ã—è —Å—Ü–≤—è—Ä–¥–∂–∞–µ, —à—Ç–æ –∞–º—ñ–ª–æ—ñ–¥–∞–ø–∞–¥–æ–±–Ω—ã –º–µ—Ö–∞–Ω—ñ–∑–º, —è–∫—ñ —Å–∫–∞—Ä–∞—á–∞–µ –∫–æ–ª—å–∫–∞—Å—Ü—å –Ω–µ–π—Ä–∞–Ω–∞–ª—å–Ω—ã—Ö —Å—É–≤—è–∑–µ–π —É –≥–∞–ª–∞—û–Ω—ã–º –º–æ–∑–≥—É —û —Ñ–∞–∑–µ —Ö—É—Ç–∫–∞–≥–∞ —Ä–æ—Å—Ç—É —û –ø–∞—á–∞—Ç–∫—É –∂—ã—Ü—Ü—è, –º–æ–∂–∞ –±—ã—Ü—å –∑–∞–ø—É—à—á–∞–Ω—ã –∞—Å–∞—Ü—ã—è–≤–∞–Ω—ã–º—ñ –∑ —É–∑—Ä–æ—Å—Ç–∞–º –ø—Ä–∞—Ü—ç—Å–∞–º—ñ —û —Å—Ç–∞—Ä–∞—Å—Ü—ñ, —à—Ç–æ —ñ –ø—Ä—ã–≤–æ–¥–∑—ñ—Ü—å –¥–∞ —Ö–∞—Ä–∞–∫—Ç—ç—Ä–Ω–∞–π –Ω–µ—û—Ä–∞–ª–∞–≥—ñ—á–Ω–∞–π —Å—ñ–º–ø—Ç–∞–º–∞—Ç—ã–∫—ñ —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞[65]. N-–ü–ë–ê (—Ñ—Ä–∞–≥–º–µ–Ω—Ç –ü–ë–ê –∑ N-–∫–∞–Ω—Ü–∞ –ø–µ–ø—Ç—ã–¥—É) —Å—É–º–µ–∂–Ω—ã –∑ –±—ç—Ç–∞-–∞–º—ñ–ª–æ—ñ–¥–∞–º —ñ –∞–¥—à—á–∞–ø–ª—è–µ—Ü—Ü–∞ –∞–¥ –ü–ë–ê –∞–¥–Ω–æ–ª—å–∫–∞–≤—ã–º—ñ —Ñ–µ—Ä–º–µ–Ω—Ç–∞–º—ñ. N-–ü–ë–ê –∑–∞–ø—É—Å–∫–∞–µ —à–ª—è—Ö —Å–∞–º–∞–∑–Ω—ñ—à—á—ç–Ω–Ω—è, –∑–≤—è–∑–≤–∞—é—á—ã—Å—è –∑ –Ω–µ–π—Ä–∞–Ω–∞–ª—å–Ω—ã–º —Ä—ç—Ü—ç–ø—Ç–∞—Ä–∞–º, —è–∫—ñ –Ω–∞–∑—ã–≤–∞—é—Ü—å ¬´—Ä—ç—Ü—ç–ø—Ç–∞—Ä —Å–º–µ—Ä—Ü—ñ 6¬ª (–Ý–°6, —è–∫—ñ —Ç–∞–∫—Å–∞–º–∞ –≤—è–¥–æ–º—ã –ø–∞–¥ –Ω–∞–∑–≤–∞–π TNFRSF21)[65]. –Ý–°6 —É –≤—è–ª—ñ–∫—ñ—Ö –∫–æ–ª—å–∫–∞—Å—Ü—è—Ö —ç–∫—Å–ø—Ä—ç—Å—ñ—Ä—É–µ—Ü—Ü–∞ —û –∞–¥–¥–∑–µ–ª–∞—Ö —á–∞–ª–∞–≤–µ—á–∞–≥–∞ –º–æ–∑–≥–∞, —è–∫—ñ—è –Ω–∞–π–±–æ–ª–µ–π –ø–∞–∫—É—Ç—É—é—Ü—å –∞–¥ —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞, —Ç–∞–º—É –º–∞–≥—á—ã–º–∞, —à—Ç–æ N-–ü–ë–ê/–Ý–°6 —à–ª—è—Ö –º–æ–∂–∞ —Å—Ç–≤–∞—Ä–∞—Ü—å –ø–∞—à–∫–æ–¥–∂–∞–Ω–Ω—ñ —û —Å—Ç–∞—Ä—ç—é—á—ã–º –º–æ–∑–≥—É. –£ –≥—ç—Ç–∞–π –º–∞–¥—ç–ª—ñ –±—ç—Ç–∞-–∞–º—ñ–ª–æ—ñ–¥ —ñ–≥—Ä–∞–µ –∫–∞–º–ø–ª–µ–º–µ–Ω—Ç–∞—Ä–Ω—É—é —Ä–æ–ª—é, –ø–∞—Ä—É—à–∞—é—á—ã —Å—ñ–Ω–∞–ø—Ç—ã—á–Ω—É—é —Ñ—É–Ω–∫—Ü—ã—é. –¢–∞—É-–≥—ñ–ø–æ—Ç—ç–∑–∞ –°—É—Ç–Ω–∞—Å—Ü—å —Ç–∞—É-–≥—ñ–ø–æ—Ç—ç–∑—ã —û —Ç—ã–º, —à—Ç–æ –ø–∞—Ä—É—à—ç–Ω–Ω—ñ –Ω–∞—Ä–º–∞–ª—å–Ω–∞–π —Å—Ç—Ä—É–∫—Ç—É—Ä—ã —Ç–∞—É-–±—è–ª–∫–∞ –º–æ–≥—É—Ü—å –ø—Ä—ã–≤–µ—Å—Ü—ñ –¥–∞ —Ä–∞–∑–≤—ñ—Ü—Ü—è –∫–∞—Å–∫–∞–¥–∞ —Ö–≤–∞—Ä–æ–±—ã[66]. –£ –∞–¥–ø–∞–≤–µ–¥–Ω–∞—Å—Ü—ñ –∑ –≥—ç—Ç–∞–π –º–∞–¥—ç–ª–ª—é, –≥—ñ–ø–µ—Ä—Ñ–∞—Å—Ñ–∞—Ä—ã–ª—ñ—Ä–∞–≤–∞–Ω—ã —Ç–∞—É –ø–∞—á—ã–Ω–∞–µ –≥—Ä—É–ø–∞–≤–∞—Ü—Ü–∞ —û –ø–∞—Ä—ã –∑ —ñ–Ω—à—ã–º—ñ –Ω—ñ—Ç–∫–∞–º—ñ —Ç–∞—É. –£ –≤—ã–Ω—ñ–∫—É —û—Ç–≤–∞—Ä–∞—é—Ü—Ü–∞ –Ω–µ–π—Ä–∞—Ñ—ñ–±—Ä—ã–ª—è—Ä–Ω—ã—è –∫–ª—É–±–∫—ñ —û–Ω—É—Ç—Ä—ã —Ü–µ–ª–∞—û –Ω–µ—Ä–≤–æ–≤—ã—Ö –∫–ª–µ—Ç–∞–∫[67]. –ö–∞–ª—ñ –≥—ç—Ç–∞ –∞–¥–±—ã–≤–∞–µ—Ü—Ü–∞, –º—ñ–∫—Ä–∞—Ç—É–±—É–ª—ã –¥—ç–∑—ã–Ω—Ç—ç–≥—Ä—É—é—Ü—å, —Ä–∞–∑–±—É—Ä–∞—é—á—ã —Å—Ç—Ä—É–∫—Ç—É—Ä—ã –∫–ª–µ—Ç–∞—á–Ω–∞–≥–∞ —Ü—ã—Ç–∞—à–∫—ñ–ª–µ—Ç–∞, —à—Ç–æ –ø—Ä—ã–≤–æ–¥–∑—ñ—Ü—å –¥–∞ –±–ª–æ–∫—É —Ç—Ä–∞–Ω—Å–ø–∞—Ä—Ç–Ω–∞–π —Å—ñ—Å—Ç—ç–º—ã –Ω–µ–π—Ä–æ–Ω–∞[68]. –°–ø–∞—á–∞—Ç–∫—É –≥—ç—Ç–∞ –º–æ–∂–∞ –ø—Ä–∞—è–≤—ñ—Ü—Ü–∞ —û –ø–∞—Ä—É—à—ç–Ω–Ω—è—Ö –±—ñ—è—Ö—ñ–º—ñ—á–Ω–∞–π –∫–∞–º—É–Ω—ñ–∫–∞—Ü—ã—ñ –ø–∞–º—ñ–∂ –Ω–µ–π—Ä–æ–Ω–∞–º—ñ, –∞ –ø–æ—Ç—ã–º –ø—Ä—ã–≤–µ—Å—Ü—ñ –¥–∞ —Å–º–µ—Ä—Ü—ñ –∫–ª–µ—Ç–∞–∫[69]. –Ü–Ω—à—ã—è –≥—ñ–ø–æ—Ç—ç–∑—ã–ú–µ—Ä–∫–∞–≤–∞–ª–∞—Å—è, —à—Ç–æ –≤—ñ—Ä—É—Å –ø—Ä–æ—Å—Ç–∞–≥–∞ –≥–µ—Ä–ø–µ—Å—É 1 —Ç—ã–ø—É –≥—Ä–∞–µ –ø—Ä—ã—á—ã–Ω–Ω—É—é —Ä–æ–ª—é —û —Ä–∞–∑–≤—ñ—Ü—Ü—ñ —Ö–≤–∞—Ä–æ–±—ã —û –ª—é–¥–∑–µ–π, —è–∫—ñ—è –º–∞—é—Ü—å –≥–µ–Ω –ê–ü–ê–ï[70]. –ö–ª–µ—Ç–∞—á–Ω—ã –≥–∞–º–µ–∞—Å—Ç–∞–∑ —ñ–æ–Ω–Ω—ã—Ö –º–µ–¥–∑—ñ, –∂–∞–ª–µ–∑–∞ —ñ —Ü—ã–Ω–∫—É –ø–∞—Ä—É—à–∞–µ—Ü—Ü–∞ –ø—Ä—ã —Ö–≤–∞—Ä–æ–±–µ –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞, —Ç–∞–º—É –¥–∞–≥—ç—Ç—É–ª—å –∑–∞—Å—Ç–∞–µ—Ü—Ü–∞ –Ω–µ–≤—è–¥–æ–º—ã–º, —Ü—ñ –∑‚Äô—è—û–ª—è–µ—Ü—Ü–∞ –≥—ç—Ç–∞ –ø—Ä—ã—á–∞–Ω–∞–π –∑–º–µ–Ω —É –±—è–ª–∫–∞—Ö –∞–±–æ, –Ω–∞–∞–¥–≤–∞—Ä–æ—Ç, –≥—ç—Ç–∞ –Ω–∞—Å—Ç—É–ø—Å—Ç–≤–∞ –±—è–ª–∫–æ–≤—ã—Ö –∑–º–µ–Ω. –ö–∞–Ω—Ü—ç–Ω—Ç—Ä–∞—Ü—ã—è —ñ–æ–Ω–∞—û –∑–∞–ª–µ–∂—ã—Ü—å (—Ü—ñ —û–ø–ª—ã–≤–∞–µ) –Ω–∞ —Ç–∞—É, –ü–ë–ê —ñ –ê–ü–ê–ï[71]. –ù–µ–∫–∞—Ç–æ—Ä—ã—è –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω—ñ –ø–∞–∫–∞–∑–∞–ª—ñ —Å—É–≤—è–∑—å –ø–∞–≤—ã—à–∞–Ω–∞–π —Ä—ã–∑—ã–∫—ñ —Ä–∞–∑–≤—ñ—Ü—Ü—è —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ –∑ —Ñ–∞–∫—Ç–∞—Ä–∞–º—ñ –Ω–∞–≤–∞–∫–æ–ª—å–Ω–∞–≥–∞ –∞—Å—è—Ä–æ–¥–¥–∑—è, —è–∫, –Ω–∞–ø—Ä—ã–∫–ª–∞–¥, –ø—Ä–∞–∑–º–µ—Ä–Ω–∞–µ –ø–∞–ø–∞–¥–∞–Ω–Ω–µ —û –∞—Ä–≥–∞–Ω—ñ–∑–º –º–µ—Ç–∞–ª–∞—û, —É –ø—Ä—ã–≤–∞—Ç–Ω–∞—Å—Ü—ñ –∞–ª—é–º—ñ–Ω—ñ—é[72]. –ó—Ä—ç—à—Ç—ã, —è–∫–∞—Å—Ü—å –Ω–µ–∫–∞—Ç–æ—Ä—ã—Ö –∑ –≥—ç—Ç—ã—Ö –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω—è—û –∫—Ä—ã—Ç—ã–∫–∞–≤–∞–ª–∞—Å—è[73][74], —ñ —ñ–Ω—à—ã—è –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω—ñ –ø—Ä—ã–π—à–ª—ñ –¥–∞ –≤—ã—Å–Ω–æ–≤—ã, —à—Ç–æ –Ω—è–º–∞ —Å—É–≤—è–∑—ñ –ø–∞–º—ñ–∂ —Ñ–∞–∫—Ç–∞—Ä–∞–º—ñ –Ω–∞–≤–∞–∫–æ–ª—å–Ω–∞–≥–∞ –∞—Å—è—Ä–æ–¥–¥–∑—è —ñ —Ä–∞–∑–≤—ñ—Ü—Ü—ë–º —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞[75]. –ù–µ–∫–∞—Ç–æ—Ä—ã—è –¥–∞—Å–ª–µ–¥—á—ã–∫—ñ –∑—Ä–∞–±—ñ–ª—ñ –∑–¥–∞–≥–∞–¥–∫—É, —à—Ç–æ —Ö–∞—Ä—á–æ–≤–∞—è –º–µ–¥–∑—å –º–æ–∂–∞ –≥—Ä–∞—Ü—å –ø—Ä—ã—á—ã–Ω–Ω—É—é —Ä–æ–ª—é[76]. –£ —Ç–æ–π —á–∞—Å, –∫–∞–ª—ñ –Ω–µ–∫–∞—Ç–æ—Ä—ã—è –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω—ñ —Å—Ü–≤—è—Ä–¥–∂–∞—é—Ü—å, —à—Ç–æ —ç–∫—Å—Ç—Ä—ç–º–∞–ª—å–Ω–∞ –Ω—ñ–∑–∫—ñ—è —á–∞—Å—Ç–æ—Ç—ã —ç–ª–µ–∫—Ç—Ä–∞–º–∞–≥–Ω—ñ—Ç–Ω—ã—Ö –ø–∞–ª—ë—û –º–æ–≥—É—Ü—å –ø–∞–≤—è–ª—ñ—á—ã—Ü—å —Ä—ã–∑—ã–∫—É —Ä–∞–∑–≤—ñ—Ü—Ü—è —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞[77], –±–æ–ª—å—à–∞—Å—Ü—å –Ω–∞–≤—É–∫–æ–≤–∞–π —Å—É–ø–æ–ª—å–Ω–∞—Å—Ü—ñ —Å—Ö—ñ–ª—è–µ—Ü—Ü–∞ –¥–∞ –¥—É–º–∞–∫, —à—Ç–æ –ø–∞—Ç—Ä–∞–±—É—é—Ü—Ü–∞ –¥–∞–ª–µ–π—à—ã—è —ç–ø—ñ–¥—ç–º—ñ—è–ª–∞–≥—ñ—á–Ω—ã—è —ñ –ª–∞–±–∞—Ä–∞—Ç–æ—Ä–Ω—ã—è –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω—ñ, –∫–∞–± –ø—Ä–∞–ª—ñ—Ü—å —Å–≤—è—Ç–ª–æ –Ω–∞ –≥—ç—Ç—É –≥—ñ–ø–æ—Ç—ç–∑—É[78]. –ö—É—Ä—ç–Ω–Ω–µ –∑‚Äô—è—û–ª—è–µ—Ü—Ü–∞ –∑–Ω–∞—á–Ω—ã–º —Ñ–∞–∫—Ç–∞—Ä–∞–º —Ä—ã–∑—ã–∫—ñ —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞[79]. –°—ñ—Å—Ç—ç–º–Ω—ã—è –º–∞—Ä–∫–µ—Ä—ã –ø—Ä—ã—Ä–æ–¥–∂–∞–Ω–∞–≥–∞ —ñ–º—É–Ω—ñ—Ç—ç—Ç—É –∑‚Äô—è—û–ª—è—é—Ü—Ü–∞ —Ñ–∞–∫—Ç–∞—Ä–∞–º—ñ —Ä—ã–∑—ã–∫—ñ –ø–æ–∑–Ω—è–π —Ñ–æ—Ä–º—ã —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞[80]. –Ü–Ω—à–∞—è –≥—ñ–ø–æ—Ç—ç–∑–∞ –∑–≤—è–∑–≤–∞–µ —Ö–≤–∞—Ä–æ–±—É –∑ –Ω–∞—Ç—É—Ä–∞–ª—å–Ω—ã–º (–ø—Ä–∞–∑ —Å—Ç–∞—Ä—ç–Ω–Ω–µ) —Ä–∞—Å–ø–∞–¥–∞–º –º—ñ—ç–ª—ñ–Ω—É —û –≥–∞–ª–∞—û–Ω—ã–º –º–æ–∑–≥—É. –ñ–∞–ª–µ–∑–∞, —è–∫–æ–µ –≤—ã—Å–≤–∞–±–∞–¥–∂–∞–µ—Ü—Ü–∞ —û –≤—ã–Ω—ñ–∫—É —Å—Ç–∞—Ä—ç–Ω–Ω—è, –º–∞–≥—á—ã–º–∞, —ñ –≤—ã–∫–ª—ñ–∫–∞–µ –¥–∞–ª–µ–π—à—ã—è –ø–∞—à–∫–æ–¥–∂–∞–Ω–Ω—ñ. –ì–∞–º–µ–∞—Å—Ç–∞—Ç—ã—á–Ω—ã—è –ø—Ä–∞—Ü—ç—Å—ã —Ä—ç–ø–∞—Ä–∞—Ü—ã—ñ –º—ñ—ç–ª—ñ–Ω—É —Å–ø—Ä—ã—è—é—Ü—å —Ä–∞–∑–≤—ñ—Ü—Ü—é —Ç–∞–∫—ñ—Ö –±—è–ª–∫–æ–≤—ã—Ö –Ω–∞–∑–∞–ø–∞—à–≤–∞–Ω–Ω—è—û, —è–∫ –±—ç—Ç–∞-–∞–º—ñ–ª–æ—ñ–¥ —ñ —Ç–∞—É[81][82][83]. –ê–∫—ñ—Å–ª—è–ª—å–Ω—ã —Å—Ç—Ä—ç—Å —ñ –ø–∞—Ä—É—à—ç–Ω–Ω—ñ –≥–∞–º–µ–∞—Å—Ç–∞–∑—É —û –º–µ—Ç–∞–±–∞–ª—ñ–∑–º–µ –±—ñ—è–º–µ—Ç–∞–ª–∞—û –º–æ–≥—É—Ü—å —û–Ω–æ—Å—ñ—Ü—å –∑–Ω–∞—á–Ω—ã —û–∫–ª–∞–¥ —É —Ä–∞–∑–≤—ñ—Ü—Ü—ë –ø–∞—Ç–∞–ª–æ–≥—ñ—ñ[84][85][86]. –ó –≥—ç—Ç–∞–≥–∞ –ø—É–Ω–∫—Ç—É –≥–ª–µ–¥–∂–∞–Ω–Ω—è, –∞–Ω—Ç—ã–∞–∫—Å—ñ–¥–∞–Ω—Ç—ã –∑ –Ω—ñ–∑–∫–∞–π –º–∞–ª–µ–∫—É–ª—è—Ä–Ω–∞–π –º–∞—Å–∞–π, —è–∫, –Ω–∞–ø—Ä—ã–∫–ª–∞–¥, –º–µ–ª–∞—Ç–∞–Ω—ñ–Ω, –±—É–¥—É—Ü—å –ø–µ—Ä—Å–ø–µ–∫—Ç—ã—û–Ω—ã–º—ñ —û –ø—Ä–∞—Ñ—ñ–ª–∞–∫—Ç—ã—Ü—ã —ñ –ª—è—á—ç–Ω–Ω—ñ[87]. –•–≤–æ—Ä—ã—è –Ω–∞ —Ö–≤–∞—Ä–æ–±—É –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ –ª—é–¥–∑—ñ –º–∞—é—Ü—å —Å—Ç—Ä–∞—Ç—É 70 % –∫–ª–µ—Ç–∞–∫ –±–ª–∞–∫—ñ—Ç–Ω–∞–π –ø–ª—è–º—ã, —è–∫—ñ—è –ø—Ä–∞–¥—É—Ü—ã—Ä—É—é—Ü—å –Ω–æ—Ä–∞–¥—Ä—ç–Ω–∞–ª—ñ–Ω (–¥–∞–¥–∞—Ç–∫–æ–≤—ã –Ω–æ—Ä–∞–¥—Ä—ç–Ω–∞–ª—ñ–Ω, –±–æ —è–≥–æ —è–∫ –Ω–µ–π—Ä–∞–º–µ–¥—ã—è—Ç–∞—Ä–∞ —Ö–∞–ø–∞–µ), —è–∫—ñ –ª–∞–∫–∞–ª—å–Ω–∞ –¥—ã—Ñ—É–Ω–¥–∑—ñ—Ä—É–µ –∑ ¬´–ø—É—Ö—ñ—Ä–æ—á–∫–∞—û¬ª —É —è–∫–∞—Å—Ü—ñ —ç–Ω–¥–∞–≥–µ–Ω–Ω–∞–≥–∞ —Å—É–ø—Ä–∞—Ü—å–∑–∞–ø–∞–ª–µ–Ω—á–∞–≥–∞ –∞–≥–µ–Ω—Ç—É —û –º—ñ–∫—Ä–∞–∞—Å—è—Ä–æ–¥–¥–∑—ñ –≤–∞–∫–æ–ª –Ω–µ–π—Ä–æ–Ω–∞—û, –≥–ª—ñ—è–ª—å–Ω—ã—Ö –∫–ª–µ—Ç–∞–∫ —ñ –∫—Ä—ã–≤—è–Ω–æ—Å–Ω—ã—Ö —Å—É–¥–∑—ñ–Ω —É –Ω–µ–∞–∫–æ—Ä—Ç—ç–∫—Å–µ —ñ –≥—ñ–ø–∞–∫–∞–º–ø–µ[88]. –ë—ã–ª–æ –≤—ã—Å–≤–µ—Ç–ª–µ–Ω–∞, —à—Ç–æ –Ω–æ—Ä–∞–¥—Ä—ç–Ω–∞–ª—ñ–Ω —Å—Ç—ã–º—É–ª—é–µ –º—ñ–∫—Ä–∞–≥–ª—ñ—é –º—ã—à—ç–π —Å–ø—ã–Ω—è—Ü—å AŒ≤-—ñ–Ω–¥—É—Ü—ã—Ä–∞–≤–∞–Ω—É—é –ø—Ä–∞–¥—É–∫—Ü—ã—é —Ü—ã—Ç–∞–∫—ñ–Ω–∞—û —ñ –Ω–∞–≤–∞—Ç —Å–ø—Ä—ã—è–µ —Ñ–∞–≥–∞—Ü—ã—Ç–æ–∑—É —Å–∞–º–æ–≥–∞ AŒ≤[88]. –ì—ç—Ç–∞ —Å–≤–µ–¥—á—ã—Ü—å –∞–± —Ç—ã–º, —à—Ç–æ –¥—ç–≥–µ–Ω–µ—Ä–∞—Ü—ã—è –±–ª–∞–∫—ñ—Ç–Ω–∞–π –ø–ª—è–º—ã –º–æ–∂–∞ –±—ã—Ü—å –ø—Ä—ã—á—ã–Ω–∞–π –ø–∞–≤—ã—à–∞–Ω–∞–≥–∞ –Ω–∞–∑–∞–ø–∞—à–≤–∞–Ω–Ω—è AŒ≤ –ø–∞–¥—á–∞—Å —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ —û –≥–∞–ª–∞—û–Ω—ã–º –º–æ–∑–≥—É[88]. –Ü—Å–Ω—É—é—Ü—å –¥–æ–∫–∞–∑—ã (–∑—Ä—ç—à—Ç—ã, —è–∫—ñ—è –º–∞—é—Ü—å –Ω–µ –Ω–∞–π–≤—ã—à—ç–π—à—É—é —Å—Ç—É–ø–µ–Ω—å –≤–µ—Ä–∞–≥–æ–¥–Ω–∞—Å—Ü—ñ), —à—Ç–æ –¥—ã—Ö–∞–Ω–Ω–µ –∑–∞–±—Ä—É–¥–∂–∞–Ω—ã–º –ø–∞–≤–µ—Ç—Ä–∞–º –º–æ–∂–∞ –±—ã—Ü—å –≤—ã—Ä–∞—à–∞–ª—å–Ω—ã–º —Ñ–∞–∫—Ç–∞—Ä–∞–º —Ä–∞–∑–≤—ñ—Ü—Ü—è —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞[89]. –ü–∞—Ç–∞–≥–µ–Ω–µ–∑–ü–∞—Ç–∞–ª–∞–≥—ñ—á–Ω–∞—è —Ñ—ñ–∑—ñ—è–ª–æ–≥—ñ—è–ù–µ–π—Ä–∞–ø–∞—Ç–∞–ª–æ–≥—ñ—è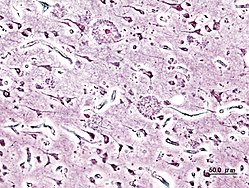 –•–≤–∞—Ä–æ–±–∞ —Ö–∞—Ä–∞–∫—Ç–∞—Ä—ã–∑—É–µ—Ü—Ü–∞ —Å—Ç—Ä–∞—Ç–∞–π –Ω–µ–π—Ä–æ–Ω–∞—û —ñ —Å—ñ–Ω–∞–ø—Ç—ã—á–Ω—ã—Ö —Å—É–≤—è–∑–µ–π —É –∫–∞—Ä—ã –≥–∞–ª–∞—û–Ω–æ–≥–∞ –º–æ–∑–≥–∞ —ñ –ø—ç—û–Ω—ã—Ö —Å—É–±–∫–∞—Ä—Ç—ã–∫–∞–ª—å–Ω—ã—Ö –∞–±—Å—è–≥–∞—Ö. –ì—ñ–±–µ–ª—å –∫–ª–µ—Ç–∞–∫ –≤—è–¥–∑–µ –¥–∞ —è—Å–∫—Ä–∞–≤–∞–π –∞—Ç—Ä–∞—Ñ—ñ—ñ –ø–∞—à–∫–æ–¥–∂–∞–Ω—ã—Ö —É—á–∞—Å—Ç–∫–∞—û, —É —Ç—ã–º –ª—ñ–∫—É –¥–∞ –¥—ç–≥–µ–Ω–µ—Ä–∞—Ü—ã—ñ —Å–∫—Ä–æ–Ω–µ–≤—ã—Ö —ñ —Ü–µ–º–µ–≤–∞–π –¥–æ–ª–µ–π, —É—á–∞—Å—Ç–∫–∞—û —Ñ—Ä–∞–Ω—Ç–∞–ª—å–Ω–∞–π –∫–∞—Ä—ã —ñ –ø–∞—è—Å–Ω–æ–π –∑–≤—ñ–ª—ñ–Ω—ã[90]. –Ø–∫ –∞–º—ñ–ª–æ—ñ–¥–Ω—ã—è –±–ª—è—à–∫—ñ, –≥—ç—Ç–∞–∫ —ñ –Ω–µ–π—Ä–∞—Ñ—ñ–±—Ä—ã–ª—è—Ä–Ω—ã—è –∫–ª—É–±–∫—ñ, –¥–æ–±—Ä–∞ –∑–∞—û–≤–∞–∂–Ω—ã—è –ø–∞–¥ –º—ñ–∫—Ä–∞—Å–∫–æ–ø–∞–º –ø–∞–¥—á–∞—Å –ø–∞—Å–º—è—Ä–æ—Ç–Ω–∞–≥–∞ –∞–Ω–∞–ª—ñ–∑—É —û–∑–æ—Ä–∞—û –º–æ–∑–≥–∞ —Ö–≤–æ—Ä—ã—Ö[91]. –ë–ª—è—à–∫—ñ —û—è—û–ª—è—é—Ü—å —Å–∞–±–æ–π —à—á—ã–ª—å–Ω—ã—è, —É –±–æ–ª—å—à–∞—Å—Ü—ñ –≤—ã–ø–∞–¥–∫–∞—û –Ω–µ—Ä–∞—Å—Ç–≤–∞—Ä–∞–ª—å–Ω—ã—è –Ω–∞–∑–∞–ø–∞—à–≤–∞–Ω–Ω—ñ –±—ç—Ç–∞-–∞–º—ñ–ª–æ—ñ–¥—É —ñ –∫–ª–µ—Ç–∞—á–Ω–∞–≥–∞ –º–∞—Ç—ç—Ä—ã—è–ª—É —û–Ω—É—Ç—Ä—ã —ñ –∑–≤–æ–Ω–∫—É –Ω–µ–π—Ä–æ–Ω–∞—û. –£–Ω—É—Ç—Ä—ã –Ω–µ—Ä–≤–æ–≤—ã—Ö –∫–ª–µ—Ç–∞–∫ —è–Ω—ã —Ä–∞—Å—Ç—É—Ü—å, —É—Ç–≤–∞—Ä–∞—é—á—ã –Ω–µ—Ä–∞—Å—Ç–≤–∞—Ä–∞–ª—å–Ω—ã—è –∑–∞–∫—Ä—É—á–∞–Ω—ã—è —Å–ø–ª—è—Ü–µ–Ω–Ω—ñ –≤–∞–ª–æ–∫–Ω–∞—û, —è–∫—ñ—è —á–∞—Å—Ç–∞ –Ω–∞–∑—ã–≤–∞—é—Ü—å –∫–ª—É–±–∫–∞–º—ñ. –£ –º–Ω–æ–≥—ñ—Ö —Å–∞—Å—Ç–∞—Ä—ç–ª—ã—Ö –ª—é–¥–∑–µ–π —É –º–æ–∑–≥—É —û—Ç–≤–∞—Ä–∞–µ—Ü—Ü–∞ –ø—ç—û–Ω–∞—è –∫–æ–ª—å–∫–∞—Å—Ü—å –±–ª—è—à–∞–∫ —ñ –∫–ª—É–±–∫–æ—û, –∞–¥–Ω–∞–∫ –ø–∞–¥—á–∞—Å —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ —ñ—Ö –±–æ–ª–µ–π —É –ø—ç—û–Ω—ã—Ö —É—á–∞—Å—Ç–∫–∞—Ö –º–æ–∑–≥–∞, —è–∫, –Ω–∞–ø—Ä—ã–∫–ª–∞–¥, —Å–∫—Ä–æ–Ω–µ–≤—ã—è –¥–æ–ª—ñ[92]. –ë—ñ—è—Ö—ñ–º—ñ—è –ë—ã–ª–æ –∑–∞—û–≤–∞–∂–∞–Ω–∞, —à—Ç–æ —Ö–≤–∞—Ä–æ–±–∞ –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ –∑–∞—û–∂–¥—ã —Å—É–ø—Ä–∞–≤–∞–¥–∂–∞–µ—Ü—Ü–∞ –ø—Ä–∞—Ç—ç—ñ–Ω–ø–∞—Ç—ã—è–π ‚Äî –Ω–∞–∑–∞–ø–∞—à–≤–∞–Ω–Ω–µ–º —É —Ç–∫–∞–Ω–∫–∞—Ö –º–æ–∑–≥–∞ –Ω–µ–Ω–∞—Ä–º–∞–ª—å–Ω–∞ –∑–≥–æ—Ä–Ω—É—Ç—ã—Ö –±—è–ª–∫–æ—û ‚Äî –±—ç—Ç–∞-–∞–º—ñ–ª–æ—ñ–¥—É —ñ —Ç–∞—É-–±—è–ª–∫–∞[93]. –ë–ª—è—à–∫—ñ —û—Ç–≤–∞—Ä–∞—é—Ü—Ü–∞ –∑ –º–∞–ª—ã—Ö –ø–µ–ø—Ç—ã–¥–∞—û –¥–∞—û–∂—ã–Ω—ë–π —É 39-43 –∞–º—ñ–Ω–∞–∫—ñ—Å–ª–∞—Ç—ã, —è–∫—ñ—è –Ω–∞–∑—ã–≤–∞—é—Ü—Ü–∞ –±—ç—Ç–∞-–∞–º—ñ–ª–æ—ñ–¥–∞–º. –ë—ç—Ç–∞-–∞–º—ñ–ª–æ—ñ–¥ –∑‚Äô—è—û–ª—è–µ—Ü—Ü–∞ —Ñ—Ä–∞–≥–º–µ–Ω—Ç–∞–º –±–æ–ª—å—à –±—É–π–Ω–æ–≥–∞ –±—è–ª–∫–∞ ‚Äî –ø–∞–ø—è—Ä—ç–¥–Ω—ñ–∫–∞ –±—ç—Ç–∞-–∞–º—ñ–ª–æ—ñ–¥—É. –ì—ç—Ç—ã —Ç—Ä–∞–Ω—Å–º–µ–º–±—Ä–∞–Ω–Ω—ã –±—è–ª–æ–∫ —ñ–≥—Ä–∞–µ –≤–∞–∂–Ω—É—é —Ä–æ–ª—é —û —Ä–æ—Å—Ü–µ –Ω–µ–π—Ä–æ–Ω–∞, —è–≥–æ –≤—ã–∂—ã–≤–∞–Ω–Ω—ñ —ñ –∞–¥–Ω–∞—û–ª–µ–Ω–Ω—ñ –ø–∞—Å–ª—è –ø–∞—à–∫–æ–¥–∂–∞–Ω–Ω—è—û[94][95]. –ü–∞–¥—á–∞—Å —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ –ø–∞ –Ω–µ–≤—è–¥–æ–º—ã—Ö –¥–∞–≥—ç—Ç—É–ª—å –ø—Ä—ã—á—ã–Ω–∞—Ö –ü–ë–ê –ø–∞–¥–≤—è—Ä–≥–∞–µ—Ü—Ü–∞ –ø—Ä–∞—Ç—ç–æ–ª—ñ–∑—É ‚Äî —Ä–∞–∑–¥–∑—è–ª—è–µ—Ü—Ü–∞ –Ω–∞ –ø–µ–ø—Ç—ã–¥—ã –ø–∞–¥ —É–∑–¥–∑–µ—è–Ω–Ω–µ–º —Ñ–µ—Ä–º–µ–Ω—Ç–∞—û[96]. –ë—ç—Ç–∞-–∞–º—ñ–ª–æ—ñ–¥–Ω—ã—è –Ω—ñ—Ü—ñ, —è–∫—ñ—è —û—Ç–≤–∞—Ä–∞—é—Ü—Ü–∞ –∞–¥–Ω—ã–º –∑ –ø–µ–ø—Ç—ã–¥–∞—û, –∑–ª—ñ–ø–∞—é—Ü—Ü–∞ —û –º—ñ–∂–∫–ª–µ—Ç–∞—á–Ω–∞–π –ø—Ä–∞—Å—Ç–æ—Ä—ã —û —à—á—ã–ª—å–Ω—ã—è —û—Ç–≤–∞—Ä—ç–Ω–Ω—ñ, —è–∫—ñ—è –ø—Ä—ã–Ω—è—Ç–∞ –Ω–∞–∑—ã–≤–∞—Ü—å —Å–µ–Ω—ñ–ª—å–Ω—ã–º—ñ –±–ª—è—à–∫–∞–º—ñ[97]. –ù–µ–Ω–∞—Ä–º–∞–ª—å–Ω–∞—è –∞–≥—Ä—ç–≥–∞—Ü—ã—è —Ç–∞—É-–±—è–ª–∫–∞ –±—ã–ª–∞ –∞–ø—ñ—Å–∞–Ω–∞ –≤—ã—à—ç–π —û —Ä–∞–∑–¥–∑–µ–ª–µ ¬´''–≠—Ç—ã—è–ª–æ–≥—ñ—è''¬ª, –ø–∞–¥—Ä–∞–∑–¥–∑–µ–ª–µ ¬´''–¢–∞—É-–≥—ñ–ø–æ—Ç—ç–∑–∞''¬ª. –ü–∞—Ç–∞–ª–∞–≥—ñ—á–Ω—ã –º–µ—Ö–∞–Ω—ñ–∑–º–ù–µ–≤—è–¥–æ–º–∞, —è–∫ –º–µ–Ω–∞–≤—ñ—Ç–∞ –ø–∞—Ä—É—à—ç–Ω–Ω–µ —Å—ñ–Ω—Ç—ç–∑—É –∑ –Ω–∞—Å—Ç—É–ø–Ω—ã–º –Ω–∞–∑–∞–ø–∞—à–≤–∞–Ω–Ω–µ–º –±—ç—Ç–∞-–∞–º—ñ–ª–æ—ñ–¥–Ω—ã—Ö –ø–µ–ø—Ç—ã–¥–∞—û –≤—ã–∫–ª—ñ–∫–∞–µ –ø–∞—Ç–∞–ª–∞–≥—ñ—á–Ω—ã—è –∞–¥—Ö—ñ–ª–µ–Ω–Ω—ñ –ø—Ä—ã —Ö–≤–∞—Ä–æ–±–µ –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞[98]. –ê–º—ñ–ª–æ—ñ–¥–Ω–∞—è –≥—ñ–ø–æ—Ç—ç–∑–∞ —Ç—Ä–∞–¥—ã—Ü—ã–π–Ω–∞ —û–∫–∞–∑–≤–∞–ª–∞ –Ω–∞ –Ω–∞–∑–∞–ø–∞—à–≤–∞–Ω–Ω–µ –±—ç—Ç–∞-–∞–º—ñ–ª–æ—ñ–¥—É —è–∫ –Ω–∞ –∞—Å–Ω–æ—û–Ω—É—é –ø–∞–¥–∑–µ—é, —è–∫–∞—è –∑–∞–ø—É—Å–∫–∞–ª–∞ –ø—Ä–∞—Ü—ç—Å –Ω–µ–π—Ä–∞–Ω–∞–ª—å–Ω–∞–π –¥—ç–≥–µ–Ω–µ—Ä–∞—Ü—ã—ñ. –ü—Ä—ã–Ω—è—Ç–∞ –ª—ñ—á—ã—Ü—å, —à—Ç–æ –Ω–∞–∑–∞–ø–∞—à–≤–∞–Ω–Ω—ñ –ø–∞—Ä—É—à–∞—é—Ü—å –≥–∞–º–µ–∞—Å—Ç–∞–∑ —ñ–æ–Ω–∞—û –∫–∞–ª—å—Ü—ã—é —û –∫–ª–µ—Ç—Ü—ã —ñ –ø—Ä–∞–≤–∞–∫—É—é—Ü—å –∞–ø–∞–ø—Ç–æ–∑[99]. –í—è–¥–æ–º–∞, —à—Ç–æ –º–µ—Å—Ü–∞–º –Ω–∞–∑–∞–ø–∞—à–≤–∞–Ω–Ω—è –±—ç—Ç–∞-–∞–º—ñ–ª–æ—ñ–¥—É —û –Ω–µ–π—Ä–æ–Ω–∞—Ö –ø–∞—Ü—ã–µ–Ω—Ç–∞—û –∑‚Äô—è—û–ª—è—é—Ü—Ü–∞ –º—ñ—Ç–∞—Ö–æ–Ω–¥—Ä—ã—ñ, —Ç–∞–∫—Å–∞–º–∞ –≥—ç—Ç—ã –ø–µ–ø—Ç—ã–¥ —ñ–Ω–≥—ñ–±—ñ—Ä—É–µ –ø—Ä–∞—Ü—É –Ω–µ–∫–∞—Ç–æ—Ä—ã—Ö —Ñ–µ—Ä–º–µ–Ω—Ç–∞—û —ñ —û–ø–ª—ã–≤–∞–µ –Ω–∞ –≤—ã–∫–∞—Ä—ã—Å—Ç–∞–Ω–Ω–µ –≥–ª—é–∫–æ–∑—ã[100]. –ó–∞–ø–∞–ª–µ–Ω—á—ã—è –ø—Ä–∞—Ü—ç—Å—ã —ñ —Ü—ã—Ç–∞–∫—ñ–Ω—ã –º–æ–≥—É—Ü—å —ñ–≥—Ä–∞—Ü—å —Ä–æ–ª—é —û –ø–∞—Ç–∞—Ñ—ñ–∑—ñ—è–ª–æ–≥—ñ—ñ. –ü–∞–∫–æ–ª—å–∫—ñ –∑–∞–ø–∞–ª–µ–Ω–Ω–µ –∑‚Äô—è—û–ª—è–µ—Ü—Ü–∞ –ø—Ä—ã–∫–º–µ—Ç–∞–π –ø–∞—à–∫–æ–¥–∂–∞–Ω–Ω—è —Ç–∫–∞–Ω–∞–∫ –ø—Ä—ã –ª—é–±–æ–π —Ö–≤–∞—Ä–æ–±–µ, –ø—Ä—ã —Ö–≤–∞—Ä–æ–±–µ –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ —è–Ω–æ –º–æ–∂–∞ –≥—Ä–∞—Ü—å –¥—Ä—É–≥–∞—Å–Ω—É—é —Ä–æ–ª—é —û –¥–∞—á—ã–Ω–µ–Ω–Ω—ñ –¥–∞ –∞—Å–Ω–æ—û–Ω–∞–π –ø–∞—Ç–∞–ª–æ–≥—ñ—ñ –∞–±–æ —û—è—û–ª—è—Ü—å —Å–∞–±–æ–π –º–∞—Ä–∫–µ—Ä —ñ–º—É–Ω–Ω–∞–π —Ä—ç–∞–∫—Ü—ã—ñ[101]. –ö—ñ—Ä—É–Ω–∫—ñ –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω—è—û–£ 2008 –≥. –±–æ–ª—å—à –∑–∞ 400 —Ñ–∞—Ä–º–∞—Ü—ç—û—Ç—ã—á–Ω—ã—Ö –ø—Ä—ç–ø–∞—Ä–∞—Ç–∞—û –∑–Ω–∞—Ö–æ–¥–∑—ñ–ª—ñ—Å—è –Ω–∞ —Å—Ç–∞–¥—ã—ñ —Ç—ç—Å—Ü—ñ—Ä–∞–≤–∞–Ω–Ω—è —û —Ä–æ–∑–Ω—ã—Ö –∫—Ä–∞—ñ–Ω–∞—Ö —Å–≤–µ—Ç—É. –ü—Ä—ã–∫–ª–∞–¥–Ω–∞ —á–≤—ç—Ä—Ü—å –∑ —ñ—Ö –ø—Ä–∞—Ö–æ–¥–∑—ñ–ª—ñ III —Ñ–∞–∑—É –∫–ª—ñ–Ω—ñ—á–Ω—ã—Ö –≤—ã–ø—Ä–∞–±–∞–≤–∞–Ω–Ω—è—û, –ø—Ä—ã –ø–∞—Å–ø—è—Ö–æ–≤—ã–º –∑–∞–≤—è—Ä—à—ç–Ω–Ω—ñ —è–∫–æ–π –ø—ã—Ç–∞–Ω–Ω–µ –∞–± —É–∂—ã–≤–∞–Ω–Ω—ñ —Å—Ä–æ–¥–∫–∞ —Ä–∞–∑–≥–ª—è–¥–∞–µ—Ü—Ü–∞ —Ä—ç–≥—É–ª—é—é—á—ã–º—ñ –æ—Ä–≥–∞–Ω–∞–º—ñ[102]. –Ü—Å–Ω—É–µ –∫—ñ—Ä—É–Ω–∞–∫ –∫–ª—ñ–Ω—ñ—á–Ω—ã—Ö –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω—è—û, —Å–∫—ñ—Ä–∞–≤–∞–Ω—ã –Ω–∞ –∫–∞—Ä—ç–∫—Ü—ã—é –±–∞–∑–∞–≤—ã—Ö –ø–∞—Ç–∞–ª–∞–≥—ñ—á–Ω—ã—Ö –∑–º–µ–Ω. –ê–¥–Ω–æ–π –∑ —Ç—ã–ø–æ–≤—ã—Ö –º—ñ—à—ç–Ω–µ–π –¥–ª—è –ø—Ä—ç–ø–∞—Ä–∞—Ç–∞—û, —è–∫—ñ—è –ø—Ä–∞—Ö–æ–¥–∑—è—Ü—å —Ç—ç—Å—Ü—ñ—Ä–∞–≤–∞–Ω–Ω–µ, –∑‚Äô—è—û–ª—è—é—Ü—Ü–∞ –Ω–∞–∑–∞–ø–∞—à–≤–∞–Ω–Ω—ñ –±—ç—Ç–∞-–∞–º—ñ–ª–æ—ñ–¥—É, —è–∫—ñ—è –Ω–µ–∞–±—Ö–æ–¥–Ω–∞ —Å–∫–∞—Ä–∞—Ü—ñ—Ü—å. –í—ã–ø—Ä–∞–±–æ—û–≤–∞—é—Ü—Ü–∞ —Ç–∞–∫—ñ—è –º–µ—Ç–∞–¥—ã, —è–∫ —ñ–º—É–Ω–∞—Ç—ç—Ä–∞–ø—ñ—è –∞–±–æ –≤–∞–∫—Ü—ã–Ω–∞—Ü—ã—è —Å—É–ø—Ä–∞—Ü—å –∞–º—ñ–ª–æ—ñ–¥–Ω–∞–≥–∞ –±—è–ª–∫—É. –£ –∞–¥—Ä–æ–∑–Ω–µ–Ω–Ω—ñ –∞–¥ –∑–≤—ã—á–∞–π–Ω–∞–π –≤–∞–∫—Ü—ã–Ω–∞—Ü—ã—ñ, —è–∫–∞—è –∞–∂—ã—Ü—Ü—è—û–ª—è–µ—Ü—Ü–∞ –∑–∞–≥–∞–¥–∑—è, —É –≤—ã–ø–∞–¥–∫—É —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ –≤–∞–∫—Ü—ã–Ω–∞ –±—É–¥–∑–µ —û–≤–æ–¥–∑—ñ—Ü—Ü–∞ –ø–∞—Ü—ã–µ–Ω—Ç–∞–º, —è–∫—ñ—è —û–∂–æ –º–∞—é—Ü—å –¥—ã—è–≥–Ω–∞–∑. –£ –∞–¥–ø–∞–≤–µ–¥–Ω–∞—Å—Ü—ñ –∑ –∫–∞–Ω—Ü—ç–ø—Ü—ã—è–π –¥–∞—Å–ª–µ–¥—á—ã–∫–∞—û, —ñ–º—É–Ω–Ω–∞—è —Å—ñ—Å—Ç—ç–º–∞ —Ö–≤–æ—Ä–∞–≥–∞ –ø–∞–≤—ñ–Ω–Ω–∞ –Ω–∞–≤—É—á—ã—Ü—Ü–∞ —Ä–∞—Å–ø–∞–∑–Ω–∞–≤–∞—Ü—å —ñ –∞—Ç–∞–∫–∞–≤–∞—Ü—å –∞–¥–∫–ª–∞–¥–∞–Ω–Ω—ñ –∞–º—ñ–ª–æ—ñ–¥—É, –∑–º—è–Ω—à–∞—é—á—ã —ñ—Ö –ø–∞–º–µ—Ä—ã —ñ –ø–∞–ª—è–≥—á–∞—é—á—ã —Ü—è—á—ç–Ω–Ω–µ —Ö–≤–∞—Ä–æ–±—ã[103][104][105]. –£ —è–∫–∞—Å—Ü—ñ –∫–∞–Ω–∫—Ä—ç—Ç–Ω–∞–≥–∞ –ø—Ä—ã–∫–ª–∞–¥—É –≤–∞–∫—Ü—ã–Ω—ã –º–æ–∂–Ω–∞ –ø—Ä—ã–≤–µ—Å—Ü—ñ –º–∞–ª–µ–∫—É–ª—É ACC-001[106][107], –∫–ª—ñ–Ω—ñ—á–Ω—ã—è –≤—ã–ø—Ä–∞–±–∞–≤–∞–Ω–Ω—ñ —è–∫–æ–π –±—ã–ª—ñ –∑–∞–º–∞—Ä–æ–∂–∞–Ω—ã —û 2008 –≥.[108] –Ü–Ω—à—ã –ø–∞–¥–æ–±–Ω—ã —Å—Ä–æ–¥–∞–∫ ‚Äî –±–∞–ø—ñ–Ω–µ–π–∑—É–º–∞–±, —à—Ç—É—á–Ω–∞–µ –∞–Ω—Ç—ã—Ü–µ–ª–∞, —è–∫–æ–µ –ø–∞ —Å–≤–∞—ë–π —Å—É—Ç–Ω–∞—Å—Ü—ñ —ñ–¥—ç–Ω—Ç—ã—á–Ω–∞–µ –Ω–∞—Ç—É—Ä–∞–ª—å–Ω–∞–º—É –ø—Ä–æ—Ü—ñ–∞–º—ñ–ª–æ—ñ–¥–Ω–∞–º—É –∞–Ω—Ç—ã—Ü–µ–ª—É[109]. –¢–∞–∫—Å–∞–º–∞ —û —Ä–∞—Å–ø—Ä–∞—Ü–æ—û—Ü—ã –∑–Ω–∞—Ö–æ–¥–∑—è—Ü—Ü–∞ –Ω–µ–π—Ä–∞–ø—Ä–∞—Ç—ç–∫—Ç–∞—Ä–Ω—ã—è —Å—Ä–æ–¥–∫—ñ, –Ω–∞–ø—Ä—ã–∫–ª–∞–¥, AL-108[110], —ñ —ñ–Ω–≥—ñ–±—ñ—Ç–∞—Ä—ã –º–µ—Ç–∞–ª–∞-–±—è–ª–∫–æ–≤—ã—Ö —É–∑–∞–µ–º–∞–¥–∑–µ—è–Ω–Ω—è—û, —Ç–∞–∫—ñ—è —è–∫ PBT2[111]. –ì—ñ–±—Ä—ã–¥–Ω—ã –±—è–ª–æ–∫ —ç—Ç–∞–Ω–µ—Ä—Ü—ç–ø—Ç, —è–∫—ñ –¥–∑–µ–π–Ω—ñ—á–∞–µ —è–∫ TNF-—ñ–Ω–≥—ñ–±—ñ—Ç–∞—Ä, –¥—ç–º–∞–Ω—Å—Ç—Ä—É–µ –∞–±–Ω–∞–¥–∑–µ–π–≤–∞—é—á—ã—è –≤—ã–Ω—ñ–∫—ñ[112][113][114]. –ü–∞–¥—á–∞—Å –∫–ª—ñ–Ω—ñ—á–Ω—ã—Ö –≤—ã–ø—Ä–∞–±–∞–≤–∞–Ω–Ω—è—û, –ø—Ä–∞–≤–µ–¥–∑–µ–Ω—ã—Ö —É 2008 –≥., —É –ø–∞—Ü—ã–µ–Ω—Ç–∞—û –Ω–∞ –ø–∞—á–∞—Ç–∫–æ–≤–∞–π —ñ —û–º–µ—Ä–∞–Ω–∞–π —Å—Ç–∞–¥—ã—è—Ö –±—ã–ª—ñ –∞–¥–∑–Ω–∞—á–∞–Ω—ã —Å—Ç–∞–Ω–æ—û—á—ã—è –∑—Ä—É—Ö—ñ —û —Ü—è—á—ç–Ω–Ω—ñ —Ö–≤–∞—Ä–æ–±—ã –ø–∞–¥ —É–∑–¥–∑–µ—è–Ω–Ω–µ–º —Ç—ç—Ç—Ä–∞–º–µ—Ç—ã–ª—Ç—ã—è–Ω—ñ–Ω—É —Ö–ª–∞—Ä—ã–¥—É, —è–∫—ñ —ñ–Ω–≥—ñ–±—ñ—Ä—É–µ –∞–≥—Ä—ç–≥–∞—Ü—ã—é —Ç–∞—É-–±—è–ª–∫—É[115][116] —ñ –∞–Ω—Ç—ã–≥—ñ—Å—Ç–∞–º—ñ–Ω—É –¥—ã–º–µ–±–æ–Ω—É[117]. –ö–∞–± –∑–∞–±—è—Å–ø–µ—á—ã—Ü—å –≤—É—á–æ–Ω—ã–º –∑ —Ä–æ–∑–Ω—ã—Ö –∫—Ä–∞—ñ–Ω –º–∞–≥—á—ã–º–∞—Å—Ü—å –∞–±–º–µ–Ω—å–≤–∞—Ü—Ü–∞ —ñ–¥—ç—è–º—ñ —ñ –≥—ñ–ø–æ—Ç—ç–∑–∞–º—ñ, –∞ —Ç–∞–∫—Å–∞–º–∞ –¥–∞—Ü—å –º–∞–≥—á—ã–º–∞—Å—Ü—å —É—Å—ñ–º –∑–∞—Ü—ñ–∫–∞—û–ª–µ–Ω—ã–º –∞—Ç—Ä—ã–º–∞—Ü—å –∑–≤–µ—Å—Ç–∫—ñ –∞–± –Ω–∞–π–Ω–æ—û—à—ã—Ö –Ω–∞–≤—É–∫–æ–≤—ã—Ö –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω—è—Ö, –±—ã—û —Å—Ç–≤–æ—Ä–∞–Ω—ã –∞–Ω–ª–∞–π–Ω-–ø—Ä–∞–µ–∫—Ç ¬´Alzheimer Research Forum¬ª. –£ –∫–∞—Å—Ç—Ä—ã—á–Ω—ñ–∫—É 2000 –≥. –≤—É—á–æ–Ω—ã–º—ñ —Å–∞ –°—Ç—ç–Ω—Ñ–∞—Ä–¥—Å–∫–∞–≥–∞ —û–Ω—ñ–≤–µ—Ä—Å—ñ—Ç—ç—Ç–∞ –±—ã—û –∑–∞–ø—É—à—á–∞–Ω—ã –ø—Ä–∞–µ–∫—Ç —Ä–∞–∑–º–µ—Ä–∫–∞–≤–∞–Ω—ã—Ö –≤—ã–ª—ñ—á—ç–Ω–Ω—è—û ¬´Folding@home¬ª –¥–ª—è –∫–∞–º–ø‚Äô—é—Ç–∞—Ä–Ω–∞–≥–∞ –º–∞–¥—ç–ª—è–≤–∞–Ω–Ω—è –∑–≥–æ—Ä—Ç–≤–∞–Ω–Ω—è (—Ñ–æ–ª–¥—ã–Ω–≥—É) –º–∞–ª–µ–∫—É–ª –±—è–ª–∫–æ—û —ñ –≤—ã—è—û–ª–µ–Ω–Ω—è –ø—Ä—ã—á—ã–Ω —É–∑–Ω—ñ–∫–Ω–µ–Ω–Ω—è —Ö–≤–∞—Ä–æ–±, —è–∫—ñ—è –≤—ã–∫–ª—ñ–∫–∞—é—Ü—Ü–∞ –¥—ç—Ñ–µ–∫—Ç–Ω—ã–º—ñ –±—è–ª–∫–∞–º—ñ: –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞, –ü–∞—Ä–∫—ñ–Ω—Å–æ–Ω–∞ —ñ —ñ–Ω—à—ã—Ö. –ö–ª—ñ–Ω—ñ—á–Ω–∞—è –∫–∞—Ä—Ü—ñ–Ω–∞–¶—è—á—ç–Ω–Ω–µ —Ö–≤–∞—Ä–æ–±—ã –ø–∞–¥–∑—è–ª—è—é—Ü—å –Ω–∞ —á–∞—Ç—ã—Ä—ã —Å—Ç–∞–¥—ã—ñ, –ø—Ä—ã—á—ã–º –ø–∞–¥—á–∞—Å –∑–º–µ–Ω—ã —Å—Ç–∞–¥—ã–π –Ω–∞–∑—ñ—Ä–∞–µ—Ü—Ü–∞ –ø—Ä–∞–≥—Ä—ç—Å –∫–∞–≥–Ω—ñ—Ç—ã—û–Ω—ã—Ö —ñ —Ñ—É–Ω–∫—Ü—ã—è–Ω–∞–ª—å–Ω—ã—Ö –ø–∞—Ä—É—à—ç–Ω–Ω—è—û. –ü—Ä—ç–¥—ç–º–µ–Ω—Ü—ã—è–ü–µ—Ä—à—ã—è —Å—ñ–º–ø—Ç–æ–º—ã —Ö–≤–∞—Ä–æ–±—ã —á–∞—Å—Ç–∞ –±–ª—ã—Ç–∞—é—Ü—å –∑ –ø—Ä–∞—è–≤–∞–º—ñ —Å—Ç–∞—Ä—ç–Ω–Ω—è –∞–±–æ —Ä—ç–∞–∫—Ü—ã—è–π –Ω–∞ —Å—Ç—Ä—ç—Å[6]. –ù–∞–π–±–æ–ª—å—à —Ä–∞–Ω–Ω—ñ—è –∫–∞–≥–Ω—ñ—Ç—ã—û–Ω—ã—è —Ü—è–∂–∫–∞—Å—Ü—ñ –≤—ã—è—û–ª—è—é—Ü—Ü–∞ —û –Ω–µ–∫–∞—Ç–æ—Ä—ã—Ö –ª—é–¥–∑–µ–π –ø—Ä—ã –¥—ç—Ç–∞–ª—ë–≤—ã–º –Ω–µ–π—Ä–∞–∫–∞–≥–Ω—ñ—Ç—ã—û–Ω—ã–º —Ç—ç—Å—Ü—ñ—Ä–∞–≤–∞–Ω–Ω—ñ –∑–∞ 8 –≥–∞–¥–æ—û –¥–∞ –ø–∞—Å—Ç–∞–Ω–æ—û–∫—ñ –¥—ã—è–≥–Ω–∞–∑—É[118][119][120]. –ì—ç—Ç—ã—è –ø–µ—Ä—à–∞–ø–∞—á–∞—Ç–∫–æ–≤—ã—è —Å—ñ–º–ø—Ç–æ–º—ã –º–æ–≥—É—Ü—å –∞–¥–±—ñ–≤–∞—Ü—Ü–∞ –Ω–∞ –≤—ã–∫–∞–Ω–∞–Ω–Ω—ñ –Ω–µ —Å–∞–º—ã—Ö —Ü—è–∂–∫—ñ—Ö —à—Ç–æ–¥–∑—ë–Ω–Ω—ã—Ö –∑–∞–¥–∞—á[121]. –ù–∞–π–±–æ–ª—å—à –∑–∞—û–≤–∞–∂–Ω—ã —Ä–∞–∑–ª–∞–¥ –ø–∞–º—è—Ü—ñ, —è–∫—ñ –≤—ã—è—û–ª—è–µ—Ü—Ü–∞ —û —Ü—è–∂–∫–∞—Å—Ü—ñ –ø—Ä—ã —Å–ø—Ä–æ–±–µ —û—Å–ø–æ–º–Ω—ñ—Ü—å –Ω—è–¥–∞—û–Ω–∞ –∑–∞–≤—É—á–∞–Ω—ã—è —Ñ–∞–∫—Ç—ã —ñ —û –Ω—è–∑–¥–æ–ª—å–Ω–∞—Å—Ü—ñ –∑–∞—Å–≤–æ—ñ—Ü—å –Ω–æ–≤—É—é —ñ–Ω—Ñ–∞—Ä–º–∞—Ü—ã—é[122][123]. –ú–∞–ª–∞–∑–∞—û–≤–∞–∂–Ω—ã—è –ø—Ä–∞–±–ª–µ–º—ã –≤—ã–∫–∞–Ω–∞—û—á—ã—Ö —Ñ—É–Ω–∫—Ü—ã–π: –∑–∞—Å—è—Ä–æ–¥–∂–∞–Ω–∞—Å—Ü—ñ, –ø–ª–∞–Ω–∞–≤–∞–Ω–Ω—è, –∫–∞–≥–Ω—ñ—Ç—ã—û–Ω–∞–π –≥–Ω—É—Ç–∫–∞—Å—Ü—ñ —ñ –∞–±—Å—Ç—Ä–∞–∫—Ç–Ω–∞–≥–∞ –º—ã—Å–ª–µ–Ω–Ω—è –∞–±–æ –ø–∞—Ä—É—à—ç–Ω–Ω–µ —Å–µ–º–∞–Ω—Ç—ã—á–Ω–∞–π –ø–∞–º—è—Ü—ñ (–ø–∞–º—è—Ü—å –∞–± –∑–Ω–∞—á—ç–Ω–Ω—ñ —Å–ª–æ—û, –∞–± —É–∑–∞–µ–º–∞–∞–¥–Ω–æ—Å—ñ–Ω–∞—Ö –∫–∞–Ω—Ü—ç–ø—Ü—ã–π) ‚Äî —Ç–∞–∫—Å–∞–º–∞ –º–æ–≥—É—Ü—å –±—ã—Ü—å —Å—ñ–º–ø—Ç–æ–º–∞–º —Ä–∞–Ω–Ω—ñ—Ö —Å—Ç–∞–¥—ã–π —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞[124][125]. –ù–∞ –≥—ç—Ç–∞–π —Å—Ç–∞–¥—ã—ñ –º–æ–∂–∞ –∞–¥–∑–Ω–∞—á–∞—Ü—Ü–∞ –∞–ø–∞—Ç—ã—è, —è–∫–∞—è –∑–∞—Å—Ç–∞–µ—Ü—Ü–∞ —Å–∞–º—ã–º —É—Å—Ç–æ–π–ª—ñ–≤—ã–º –Ω–µ–π—Ä–∞–ø—Å—ñ—Ö—ñ—è—Ç—Ä—ã—á–Ω—ã–º —Å—ñ–º–ø—Ç–æ–º–∞–º –Ω–∞ –ø—Ä–∞—Ü—è–≥—É —û—Å—è–≥–æ –∑–∞—Ö–≤–æ—Ä–≤–∞–Ω–Ω—è[126][127][128]. –¢–∞–∫—Å–∞–º–∞ –ø—Ä—ç–∫–ª—ñ–Ω—ñ—á–Ω—É—é —Å—Ç–∞–¥—ã—é –Ω–∞–∑—ã–≤–∞—é—Ü—å, —É –∑–∞–ª–µ–∂–Ω–∞—Å—Ü—ñ –∞–¥ –ø–µ—Ä–∞–∫–ª–∞–¥—É —Ä–æ–∑–Ω—ã–º—ñ –∞—û—Ç–∞—Ä–∞–º—ñ —Ç—ç—Ä–º—ñ–Ω–∞ ¬´mild cognitive impairment¬ª (MCI)[129], ¬´–º—è–∫–∫—ñ–º –∫–∞–≥–Ω—ñ—Ç—ã—û–Ω—ã–º –∑–Ω—ñ–∂—ç–Ω–Ω–µ–º¬ª[130] –∞–±–æ ¬´—É–º–µ—Ä–∞–Ω—ã–º –∫–∞–≥–Ω—ñ—Ç—ã—û–Ω—ã–º –ø–∞—Ä—É—à—ç–Ω–Ω–µ–º¬ª[131], –∞–ª–µ –≤—è–¥—É—Ü—Ü–∞ —Å–ø—Ä—ç—á–∫—ñ –∞–± —Ç—ã–º, —Ü—ñ –≤–∞—Ä—Ç–∞ –≤—ã–∫–∞—Ä—ã—Å—Ç–æ—û–≤–∞—Ü—å –∞–ø–æ—à–Ω—é—é –Ω–∞–∑–≤—É –¥–ª—è –ø–∞–∑–Ω–∞—á—ç–Ω–Ω—è –ø–µ—Ä—à–∞–π —Å—Ç–∞–¥—ã—ñ —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ –∞–±–æ –≤—ã–ª—É—á—ã—Ü—å —É –∞—Å–æ–±–Ω—É—é –¥—ã—è–≥–Ω–∞—Å—Ç—ã—á–Ω—É—é –∞–¥–∑—ñ–Ω–∫—É[132]. –Ý–∞–Ω–Ω—è—è –¥—ç–º–µ–Ω—Ü—ã—è–ü—Ä–∞–≥—Ä—ç—Å—ñ—Ä—É—é—á–∞–µ –∑–Ω—ñ–∂—ç–Ω–Ω–µ –ø–∞–º—è—Ü—ñ —ñ –∞–≥–Ω–æ–∑—ñ—è –ø—Ä—ã —Ö–≤–∞—Ä–æ–±–µ –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ —Ä–∞–Ω–∞ —Ü—ñ –ø–æ–∑–Ω–∞ –≤—è–¥—É—Ü—å –¥–∞ –ø–∞—Ü–≤–µ—Ä–¥–∂–∞–Ω–Ω—è –¥—ã—è–≥–Ω–∞–∑—É. –£ –Ω–µ–≤—è–ª—ñ–∫–∞–π –∫–æ–ª—å–∫–∞—Å—Ü—ñ –ø–∞—Ü—ã–µ–Ω—Ç–∞—û –ø—Ä—ã –≥—ç—Ç—ã–º –Ω–∞ –ø–µ—Ä—à—ã –ø–ª–∞–Ω –≤—ã—Å—Ç—É–ø–∞—é—Ü—å –Ω–µ —Ä–∞–∑–ª–∞–¥—ã –ø–∞–º—è—Ü—ñ, –∞ –ø–∞—Ä—É—à—ç–Ω–Ω—ñ –º–æ–≤—ã, –≤—ã–∫–∞–Ω–∞—û—á—ã—Ö —Ñ—É–Ω–∫—Ü—ã–π, —É—Å–ø—Ä—ã–º–∞–Ω–Ω—è –∞–±–æ —Ä—É—Ö–∞–ª—å–Ω—ã—è —Ä–∞–∑–ª–∞–¥—ã (–∞–ø—Ä–∞–∫—Å—ñ—è)[133]. –•–≤–∞—Ä–æ–±–∞ –ø–∞-—Ä–æ–∑–Ω–∞–º—É –∞–¥–±—ñ–≤–∞–µ—Ü—Ü–∞ –Ω–∞ —Ä–æ–∑–Ω—ã—Ö –∞—Å–ø–µ–∫—Ç–∞—Ö –ø–∞–º—è—Ü—ñ. –°—Ç–∞—Ä—ã—è —û—Å–ø–∞–º—ñ–Ω—ã –∞–± —É–ª–∞—Å–Ω—ã–º –∂—ã—Ü—Ü—ñ (—ç–ø—ñ–∑–∞–¥—ã—á–Ω–∞—è –ø–∞–º—è—Ü—å), –¥–∞—û–Ω–æ –∑–∞–≤—É—á–∞–Ω—ã—è —Ñ–∞–∫—Ç—ã (—Å–µ–º–∞–Ω—Ç—ã—á–Ω–∞—è –ø–∞–º—è—Ü—å), —ñ–º–ø–ª—ñ—Ü—ã—Ç–Ω–∞—è –ø–∞–º—è—Ü—å (–Ω–µ—Å–≤—è–¥–æ–º–∞—è ¬´–ø–∞–º—è—Ü—å —Ü–µ–ª–∞¬ª –∞–± –ø–∞—Ä–∞–¥–∫—É –¥–∑–µ—è–Ω–Ω—è—û, –Ω–∞–ø—Ä—ã–∫–ª–∞–¥, –∞–± —Ç—ã–º, —è–∫ –≤—ã–∫–∞—Ä—ã—Å—Ç–æ—û–≤–∞—Ü—å —Å—Ç–∞–ª–æ–≤—ã—è –ø—Ä—ã–ª–∞–¥—ã) —É –º–µ–Ω—à–∞–π —Å—Ç—É–ø–µ–Ω—ñ –ø–∞—à–∫–æ–¥–∂–≤–∞—é—Ü—Ü–∞ –∞–¥ —Ä–∞–∑–ª–∞–¥—É —û –ø–∞—Ä–∞—û–Ω–∞–Ω–Ω—ñ –∑ –Ω–æ–≤—ã–º—ñ —Ñ–∞–∫—Ç–∞–º—ñ –∞–±–æ —û—Å–ø–∞–º—ñ–Ω–∞–º—ñ[134][135]. –ê—Ñ–∞–∑—ñ—è –ø–µ—Ä–∞–≤–∞–∂–Ω–∞ —Ö–∞—Ä–∞–∫—Ç–∞—Ä—ã–∑—É–µ—Ü—Ü–∞ –∑–±—è–¥–Ω–µ–Ω–Ω–µ–º —Å–ª–æ—û–Ω—ñ–∫–∞–≤–∞–≥–∞ –∑–∞–ø–∞—Å—É —ñ –∑–Ω—ñ–∂—ç–Ω–Ω–µ–º –±–µ–≥–ª–∞—Å—Ü—ñ –º–æ–≤—ã, —à—Ç–æ –∑–Ω—ñ–∂–∞–µ –∑–¥–æ–ª—å–Ω–∞—Å—Ü—å –¥–∞ –≤—É—Å–Ω–∞–≥–∞ —ñ –ø—ñ—Å—å–º–æ–≤–∞–≥–∞ –≤—ã–∫–∞–∑–≤–∞–Ω–Ω—è –¥—É–º–∞–∫. –ù–∞ –≥—ç—Ç–∞–π —Å—Ç–∞–¥—ã—ñ —Ö–≤–∞—Ä–æ–±—ã —á–∞–ª–∞–≤–µ–∫ –∑–≤—ã—á–∞–π–Ω–∞ –∑–¥–æ–ª—å–Ω—ã –∞–¥—ç–∫–≤–∞—Ç–Ω–∞ –∞–ø–µ—Ä–∞–≤–∞—Ü—å –ø—Ä–æ—Å—Ç—ã–º—ñ –ø–∞–Ω—è—Ü—Ü—è–º—ñ –ø–∞–¥—á–∞—Å –≤—É—Å–Ω—ã—Ö –∑–Ω–æ—Å—ñ–Ω[136][137][138]. –ü—Ä—ã –º–∞–ª—è–≤–∞–Ω–Ω—ñ, –ø—ñ—Å—å–º–µ, –∞–ø—Ä–∞–Ω–∞–Ω–Ω—ñ –∞–¥–∑–µ–Ω–Ω—è —ñ —ñ–Ω—à—ã—Ö –∑–∞–¥–∞—á–∞—Ö –∑ –≤—ã–∫–∞—Ä—ã—Å—Ç–∞–Ω–Ω–µ–º —Ç–æ–Ω–∫–∞–π –º–∞—Ç–æ—Ä—ã–∫—ñ —á–∞–ª–∞–≤–µ–∫ –º–æ–∂–∞ –ø–∞–¥–∞–≤–∞—Ü—Ü–∞ –Ω—è–ª–æ—û–∫—ñ–º –∑ –ø—Ä—ã—á—ã–Ω—ã –ø—ç—û–Ω—ã—Ö –ø—Ä–∞–±–ª–µ–º –∑ –∫–∞–∞—Ä–¥—ã–Ω–∞—Ü—ã—è–π —ñ –ø–ª–∞–Ω–∞–≤–∞–Ω–Ω–µ–º —Ä—É—Ö–∞—û[139]. –ó —Ü—è–≥–∞–º —á–∞—Å—É —á–∞–ª–∞–≤–µ–∫ —á–∞—Å—Ç–∞ —è—à—á—ç –∑–¥–æ–ª—å–Ω—ã –≤—ã–∫–æ–Ω–≤–∞—Ü—å –º–Ω–æ–≥—ñ—è –∑–∞–¥–∞—á—ã –Ω–µ–∑–∞–ª–µ–∂–Ω–∞, –∞–¥–Ω–∞–∫ —è–º—É –º–æ–∂–∞ –±—ã—Ü—å –ø–∞—Ç—Ä—ç–±–Ω–∞—è –¥–∞–ø–∞–º–æ–≥–∞ –∞–±–æ –¥–æ–≥–ª—è–¥ –ø—Ä—ã —Å–ø—Ä–æ–±–∞—Ö –ø—Ä–∞–≤–µ—Å—Ü—ñ –º–∞–Ω—ñ–ø—É–ª—è—Ü—ã—ñ, —è–∫—ñ—è –ø–∞—Ç—Ä–∞–±—É—é—Ü—å –∞—Å–∞–±–ª—ñ–≤—ã—Ö –∫–∞–≥–Ω—ñ—Ç—ã—û–Ω—ã—Ö –≤—ã—Å—ñ–ª–∫–∞—û[133]. –£–º–µ—Ä–∞–Ω–∞—è –¥—ç–º–µ–Ω—Ü—ã—è–ó–¥–æ–ª—å–Ω–∞—Å—Ü—å –¥–∞ –Ω–µ–∑–∞–ª–µ–∂–Ω—ã—Ö –¥–∑–µ—è–Ω–Ω—è—û –∑–Ω—ñ–∂–∞–µ—Ü—Ü–∞ –∑ –ø—Ä—ã—á—ã–Ω—ã –ø—Ä–∞–≥—Ä—ç—Å—ñ—Ä–∞–≤–∞–Ω–Ω—è —Ö–≤–∞—Ä–æ–±—ã —ñ –ø–∞–≥–∞—Ä—à—ç–Ω–Ω—è —Å—Ç–∞–Ω—É –ø–∞—Ü—ã–µ–Ω—Ç–∞[133]. –Ý–∞–∑–ª–∞–¥—ã –º–æ–≤—ã —Å—Ç–∞–Ω–æ–≤—è—Ü—Ü–∞ –≤—ñ–¥–∞–≤–æ—á–Ω—ã–º—ñ, –±–æ —Å–∞ —Å—Ç—Ä–∞—Ç–∞–π –¥–æ—Å—Ç—É–ø—É –¥–∞ —Å–ª–æ—û–Ω—ñ–∫–∞–≤–∞–≥–∞ –∑–∞–ø–∞—Å—É —á–∞–ª–∞–≤–µ–∫ —É—Å—ë —á–∞—Å—Ü–µ–π –ø–∞–¥–±—ñ—Ä–∞–µ –Ω—è—Å–ª—É—à–Ω—ã—è —Å–ª–æ–≤—ã –Ω–∞ –∑–∞–º–µ–Ω—É –∑–∞–±—ã—Ç—ã–º (–ø–∞—Ä–∞—Ñ—Ä–∞–∑—ñ—è). –¢–∞–∫—Å–∞–º–∞ —ñ–¥–∑–µ —Å—Ç—Ä–∞—Ç–∞ –Ω–∞–≤—ã–∫–∞—û —á—ã—Ç–∞–Ω–Ω—è —ñ –ø—ñ—Å—å–º–∞[136][140]. –ó —á–∞—Å–∞–º —É—Å—ë –±–æ–ª–µ–π –ø–∞—Ä—É—à–∞–µ—Ü—Ü–∞ –∫–∞–∞—Ä–¥—ã–Ω–∞—Ü—ã—è –ø—Ä—ã –≤—ã–∫–∞–Ω–∞–Ω–Ω—ñ —Å–∫–ª–∞–¥–∞–Ω—ã—Ö –ø–∞—Å–ª—è–¥–æ—û–Ω–∞—Å—Ü–µ–π —Ä—É—Ö–∞—û, —à—Ç–æ –∑–Ω—ñ–∂–∞–µ –∑–¥–æ–ª—å–Ω–∞—Å—Ü—å —á–∞–ª–∞–≤–µ–∫–∞ —Å–ø—Ä–∞—û–ª—è—Ü—Ü–∞ –∑ –±–æ–ª—å—à–∞—Å—Ü—é —à—Ç–æ–¥–∑—ë–Ω–Ω—ã—Ö –∑–∞–¥–∞—á[141]. –ù–∞ –≥—ç—Ç—ã–º —ç—Ç–∞–ø–µ —û–∑–º–∞—Ü–Ω—è—é—Ü—Ü–∞ –ø—Ä–∞–±–ª–µ–º—ã –∑ –ø–∞–º—è—Ü—Ü—é, —Ö–≤–æ—Ä—ã –º–æ–∂–∞ –Ω–µ –ø–∞–∑–Ω–∞–≤–∞—Ü—å –±–ª—ñ–∑–∫—ñ—Ö —Å–≤–∞—è–∫–æ—û[142]. –ö–æ–ª—ñ—à–Ω—è—è –Ω–µ–∫—Ä–∞–Ω—É—Ç–∞—è –¥–æ—û–≥–∞—á–∞—Å–æ–≤–∞—è –ø–∞–º—è—Ü—å —Ç–∞–∫—Å–∞–º–∞ –ø–∞—Ä—É—à–∞–µ—Ü—Ü–∞[143] —ñ –∞–¥—Ö—ñ–ª–µ–Ω–Ω—ñ —û –ø–∞–≤–æ–¥–∑—ñ–Ω–∞—Ö —Å—Ç–∞–Ω–æ–≤—è—Ü—Ü–∞ –±–æ–ª—å—à –∑–∞—û–≤–∞–∂–Ω—ã–º—ñ. –ó–≤—ã—á–∞–π–Ω—ã–º—ñ –∑‚Äô—è—û–ª—è—é—Ü—Ü–∞ —Ç–∞–∫—ñ—è –Ω–µ–π—Ä–∞–ø—Å—ñ—Ö—ñ—è—Ç—Ä—ã—á–Ω—ã—è –ø—Ä–∞—è–≤—ã, —è–∫ –±–∞–¥–∑—è–∂–Ω—ñ—Ü—Ç–≤–∞, –≤—è—á—ç—Ä–Ω—è–µ –∞–±–≤–∞—Å—Ç—Ä—ç–Ω–Ω–µ (–∞–Ω–≥–ª. sundowning)[144], —Ä–∞–∑–¥—Ä–∞–∂–Ω—è–ª—å–Ω–∞—Å—Ü—å —ñ —ç–º–∞—Ü—ã—è–Ω–∞–ª—å–Ω–∞—è –ª–∞–±—ñ–ª—å–Ω–∞—Å—Ü—å, —è–∫–∞—è –≤—ã—è—û–ª—è–µ—Ü—Ü–∞ —û –ø–ª–∞—á—ã, —Å–ø–∞–Ω—Ç–∞–Ω–Ω–∞–π –∞–≥—Ä—ç—Å—ñ—ñ, —É —Å—É–ø—Ä–∞—Ü—ñ—û–ª–µ–Ω–Ω—ñ –¥–∞–ø–∞–º–æ–∑–µ —ñ –¥–æ–≥–ª—è–¥—É. –°—ñ–Ω–¥—Ä–æ–º –Ω–µ—Å–∞–ø—Ä–∞—û–¥–Ω–∞–π —ñ–¥—ç–Ω—Ç—ã—Ñ—ñ–∫–∞—Ü—ã—ñ —ñ —ñ–Ω—à—ã—è —Å—ñ–º–ø—Ç–æ–º—ã —Ç—Ä—ã–∑–Ω–µ–Ω–Ω—è —Ä–∞–∑–≤—ñ–≤–∞—é—Ü—Ü–∞ –ø—Ä—ã–∫–ª–∞–¥–Ω–∞ —û 30 % –ø–∞—Ü—ã–µ–Ω—Ç–∞—û[126][145][146][147]. –ú–æ–∂–∞ —Ä–∞–∑–≤—ñ—Ü—Ü–∞ –Ω–µ—Ç—Ä—ã–º–∞–Ω–Ω–µ –º–∞—á—ã[148]. –£ —Å–≤–∞—è–∫–æ—û —Ö–≤–æ—Ä–∞–≥–∞ —ñ –∞—Å–æ–±, —è–∫—ñ—è —è–≥–æ –¥–∞–≥–ª—è–¥–∞—é—Ü—å, –≥—ç—Ç—ã—è —Å—ñ–º–ø—Ç–æ–º—ã –≤—ã–∫–ª—ñ–∫–∞—é—Ü—å —Å—Ç—Ä—ç—Å, —è–∫—ñ –º–æ–∂–∞ –±—ã—Ü—å –∑–º–µ–Ω—à–∞–Ω—ã –ø–µ—Ä–∞–º—è—à—á—ç–Ω–Ω–µ–º –ø–∞—Ü—ã–µ–Ω—Ç–∞ –∑-–ø–∞–¥ —Ö–∞—Ç–Ω—è–≥–∞ –¥–æ–≥–ª—è–¥—É —û —Å—Ç–∞—Ü—ã—è–Ω–∞—Ä–Ω—É—é —û—Å—Ç–∞–Ω–æ–≤—É[133][149]. –¶—è–∂–∫–∞—è –¥—ç–º–µ–Ω—Ü—ã—è–ù–∞ –∞–ø–æ—à–Ω—è–π —Å—Ç–∞–¥—ã—ñ —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ –ø–∞—Ü—ã–µ–Ω—Ç —Ü–∞–ª–∫–∞–º –∑–∞–ª–µ–∂—ã—Ü—å –∞–¥ —Å—Ç–∞—Ä–æ–Ω–Ω—è–π –¥–∞–ø–∞–º–æ–≥—ñ. –í–∞–ª–æ–¥–∞–Ω–Ω–µ –º–æ–≤–∞–π —Å–∫–∞—Ä–∞—á–∞–µ—Ü—Ü–∞ –¥–∞ –≤—ã–∫–∞—Ä—ã—Å—Ç–∞–Ω–Ω—è –∞–¥–∑—ñ–Ω–∫–∞–≤—ã—Ö —Ñ—Ä–∞–∑ —ñ –Ω–∞–≤–∞—Ç –∞—Å–æ–±–Ω—ã—Ö —Å–ª–æ—û, —ñ —û –≤—ã–Ω—ñ–∫—É –º–æ–≤–∞ —Ü–∞–ª–∫–∞–º –≥—É–±–ª—è–µ—Ü—Ü–∞[136]. –ù—è–≥–ª–µ–¥–∑—è—á—ã –Ω–∞ —Å—Ç—Ä–∞—Ç—É –≤–µ—Ä–±–∞–ª—å–Ω—ã—Ö –Ω–∞–≤—ã–∫–∞—û, –ø–∞—Ü—ã–µ–Ω—Ç—ã —á–∞—Å—Ç–∞ –∑–¥–æ–ª—å–Ω—ã—è —Ä–∞–∑—É–º–µ—Ü—å —ñ –∞–¥–∫–∞–∑–≤–∞—Ü—å —É–∑–∞–µ–º–Ω–∞—Å—Ü—é –Ω–∞ —ç–º–∞—Ü—ã—è–Ω–∞–ª—å–Ω—ã—è –∑–≤–∞—Ä–æ—Ç—ã –¥–∞ —ñ—Ö[150]. –•–∞—Ü—è –Ω–∞ –≥—ç—Ç—ã–º —ç—Ç–∞–ø–µ —û—Å—ë —è—à—á—ç –º–æ–≥—É—Ü—å –±—ã—Ü—å –ø—Ä–∞—è–≤—ã –∞–≥—Ä—ç—Å—ñ—ñ, –∑–Ω–∞—á–Ω–∞ —á–∞—Å—Ü–µ–π —Å—Ç–∞–Ω —Ö–≤–æ—Ä–∞–≥–∞ —Ö–∞—Ä–∞–∫—Ç–∞—Ä—ã–∑—É–µ—Ü—Ü–∞ –∞–ø–∞—Ç—ã—è–π —ñ –∑–Ω—è—Å—ñ–ª–µ–Ω–Ω–µ–º[133], —ñ –∑ –ø—ç—û–Ω–∞–≥–∞ –º–æ–º–∞–Ω—Ç—É —ë–Ω –Ω–µ —û —Å—Ç–∞–Ω–µ –∞–∂—ã—Ü—Ü—è–≤—ñ—Ü—å –Ω–∞–≤–∞—Ç —Å–∞–º—ã—è –ø—Ä–æ—Å—Ç—ã—è –¥–∑–µ—è–Ω–Ω—ñ –±–µ–∑ —á—É–∂–æ–π –¥–∞–ø–∞–º–æ–≥—ñ. –•–≤–æ—Ä—ã –≥—É–±–ª—è–µ —Ü—è–≥–ª—ñ—Ü–∞–≤—É—é –º–∞—Å—É, –ø–µ—Ä–∞—Å–æ—û–≤–∞–µ—Ü—Ü–∞ –∑ —Ü—è–∂–∫–∞—Å—Ü—è–º—ñ —ñ –Ω–∞ –ø—ç—û–Ω—ã–º —ç—Ç–∞–ø–µ —û–∂–æ –Ω–µ –º–æ–∂–∞ –ø–∞–∫—ñ–Ω—É—Ü—å –ª–æ–∂–∞–∫[151], –∞ –ø–æ—Ç—ã–º —ñ —Å–∞–º–∞—Å—Ç–æ–π–Ω–∞ —Ö–∞—Ä—á–∞–≤–∞—Ü—Ü–∞[152]. –°–º–µ—Ä—Ü—å –∑–≤—ã—á–∞–π–Ω–∞ –Ω–∞–¥—ã—Ö–æ–¥–∑—ñ—Ü—å –ø—Ä–∞–∑ —Å—Ç–∞—Ä–æ–Ω–Ω—ñ—è —Ñ–∞–∫—Ç–∞—Ä—ã, —è–∫, –Ω–∞–ø—Ä—ã–∫–ª–∞–¥, –ø–Ω–µ—û–º–∞–Ω—ñ—è —Ü—ñ –¢–≠–õ–ê, –∞ –Ω–µ –ø—Ä–∞–∑ —Å–∞–º—É —Ö–≤–∞—Ä–æ–±—É –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞[153][154]. –î—ã—è–≥–Ω–æ—Å—Ç—ã–∫–∞ —ñ –¥—ã—Ñ–µ—Ä—ç–Ω—Ü—ã—è–ª—å–Ω—ã –¥—ã—è–≥–Ω–∞–∑ –ö–ª—ñ–Ω—ñ—á–Ω—ã –¥—ã—è–≥–Ω–∞–∑ —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ –∑–≤—ã—á–∞–π–Ω–∞ –≥—Ä—É–Ω—Ç—É–µ—Ü—Ü–∞ –Ω–∞ –∞–Ω–∞–º–Ω–µ–∑–µ –∂—ã—Ü—Ü—è, —Å–ø–∞–¥—á—ã–Ω–Ω—ã–º –∞–Ω–∞–º–Ω–µ–∑–µ, –ø—Ä—ã –≥—ç—Ç—ã–º —É–ª—ñ—á–≤–∞—é—Ü—Ü–∞ —Ö–∞—Ä–∞–∫—Ç—ç—Ä–Ω—ã—è –Ω–µ—û—Ä–∞–ª–∞–≥—ñ—á–Ω—ã—è —ñ –Ω–µ–π—Ä–∞–ø—Å—ñ—Ö–∞–ª–∞–≥—ñ—á–Ω—ã—è –ø—Ä—ã–∫–º–µ—Ç—ã —ñ –≤—ã–∫–ª—é—á–∞—é—Ü—Ü–∞ –∞–ª—å—Ç—ç—Ä–Ω–∞—Ç—ã—û–Ω—ã—è –¥—ã—è–≥–Ω–∞–∑—ã[155][156]. –ö–∞–± –∞–¥—Ä–æ–∑–Ω—ñ—Ü—å —Ö–≤–∞—Ä–æ–±—É –∞–¥ —ñ–Ω—à—ã—Ö –ø–∞—Ç–∞–ª–æ–≥—ñ–π —ñ —Ä–∞–∑–Ω–∞–≤—ñ–¥–Ω–∞—Å—Ü–µ–π –¥—ç–º–µ–Ω—Ü—ã—ñ, –º–æ–≥—É—Ü—å –±—ã—Ü—å –≤—ã–∫–∞—Ä—ã—Å—Ç–∞–Ω—ã —Å–∫–ª–∞–¥–∞–Ω—ã—è –º–µ—Ç–∞–¥—ã –º–µ–¥—ã—Ü—ã–Ω—Å–∫–∞–π –≤—ñ–∑—É–∞–ª—ñ–∑–∞—Ü—ã—ñ ‚Äî –∫–∞–º–ø‚Äô—é—Ç–∞—Ä–Ω–∞—è —Ç–∞–º–∞–≥—Ä–∞—Ñ—ñ—è, –º–∞–≥–Ω—ñ—Ç–Ω–∞-—Ä—ç–∑–∞–Ω–∞–Ω—Å–Ω–∞—è —Ç–∞–º–∞–≥—Ä–∞—Ñ—ñ—è, –∞–¥–Ω–∞—Ñ–∞—Ç–æ–Ω–Ω–∞—è —ç–º—ñ—Å—ñ–π–Ω–∞—è –∫–∞–º–ø‚Äô—é—Ç–∞—Ä–Ω–∞—è —Ç–∞–º–∞–≥—Ä–∞—Ñ—ñ—è –∞–±–æ –ø–∞–∑—ñ—Ç—Ä–æ–Ω–Ω–∞-—ç–º—ñ—Å—ñ–π–Ω–∞—è —Ç–∞–º–∞–≥—Ä–∞—Ñ—ñ—è[157]. –î–ª—è –±–æ–ª—å—à –¥–∞–∫–ª–∞–¥–Ω–∞–π –∞—Ü—ç–Ω–∫—ñ —Å—Ç–∞–Ω—É –ø—Ä–∞–≤–æ–¥–∑—ñ—Ü—Ü–∞ —Ç—ç—Å—Ü—ñ—Ä–∞–≤–∞–Ω–Ω–µ —ñ–Ω—Ç—ç–ª–µ–∫—Ç—É–∞–ª—å–Ω—ã—Ö —Ñ—É–Ω–∫—Ü—ã–π, —É —Ç—ã–º –ª—ñ–∫—É –ø–∞–º—è—Ü—ñ[6]. –ú–µ–¥—ã—Ü—ã–Ω—Å–∫—ñ—è –∞—Ä–≥–∞–Ω—ñ–∑–∞—Ü—ã—ñ —Ä–∞—Å–ø—Ä–∞—Ü–æ—û–≤–∞—é—Ü—å –¥—ã—è–≥–Ω–∞—Å—Ç—ã—á–Ω—ã—è –∫—Ä—ã—Ç—ç—Ä—ã—ñ –∑ –º—ç—Ç–∞–π –ø–∞–ª–µ–≥—á—ã—Ü—å –¥—ã—è–≥–Ω–æ—Å—Ç—ã–∫—É –ø—Ä–∞–∫—Ç—ã–∫—É—é—á–∞–º—É —û—Ä–∞—á—É —ñ —Å—Ç–∞–Ω–¥–∞—Ä—Ç—ã–∑–∞–≤–∞—Ü—å –ø—Ä–∞—Ü—ç—Å –ø–∞—Å—Ç–∞–Ω–æ—û–∫—ñ –¥—ã—è–≥–Ω–∞–∑—É. –ß–∞—Å–∞–º –¥—ã—è–≥–Ω–∞–∑ –ø–∞—Ü–≤—è—Ä–¥–∂–∞–µ—Ü—Ü–∞ –∞–±–æ —û—Å—Ç–∞–Ω–∞—û–ª—ñ–≤–∞–µ—Ü—Ü–∞ –ø–∞—Å–º—è—Ä–æ—Ç–Ω–∞ –ø—Ä—ã –≥—ñ—Å—Ç–∞–ª–∞–≥—ñ—á–Ω—ã–º –∞–Ω–∞–ª—ñ–∑–µ —Ç–∫–∞–Ω–∞–∫ –º–æ–∑–≥–∞[158]. –î—ã—è–≥–Ω–∞—Å—Ç—ã—á–Ω—ã—è –∫—Ä—ã—Ç—ç—Ä—ã—ñ–ù–∞—Ü—ã—è–Ω–∞–ª—å–Ω—ã —ñ–Ω—Å—Ç—ã—Ç—É—Ç –Ω–µ—û—Ä–∞–ª–∞–≥—ñ—á–Ω—ã—Ö —ñ –∫–∞–º—É–Ω—ñ–∫–∞—Ç—ã—û–Ω—ã—Ö —Ä–∞–∑–ª–∞–¥–∞—û —ñ —ñ–Ω—Å—É–ª—å—Ç—É (NINCDS) —ñ –ê—Å–∞—Ü—ã—è—Ü—ã—è —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ —Å–∫–ª–∞–ª—ñ –Ω–∞–±–æ—Ä –∫—Ä—ã—Ç—ç—Ä—ã—è—û, —è–∫—ñ—è –Ω–∞–π—á–∞—Å—Ü–µ–π —É–∂—ã–≤–∞—é—Ü—Ü–∞ –¥–ª—è –¥—ã—è–≥–Ω–æ—Å—Ç—ã–∫—ñ —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞[159]. –£ –∞–¥–ø–∞–≤–µ–¥–Ω–∞—Å—Ü—ñ –∑ –∫—Ä—ã—Ç—ç—Ä—ã—è–º—ñ, –¥–ª—è –ø–∞—Å—Ç–∞–Ω–æ—û–∫—ñ –∫–ª—ñ–Ω—ñ—á–Ω–∞–≥–∞ –¥—ã—è–≥–Ω–∞–∑—É —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ –ø–∞—Ç—Ä–∞–±—É–µ—Ü—Ü–∞ –ø–∞—Ü–≤–µ—Ä–¥–∑—ñ—Ü—å –Ω–∞—è—û–Ω–∞—Å—Ü—å –∫–∞–≥–Ω—ñ—Ç—ã—û–Ω—ã—Ö –ø–∞—Ä—É—à—ç–Ω–Ω—è—û —ñ –º–µ—Ä–∫–∞–≤–∞–Ω–∞–≥–∞ —Å—ñ–Ω–¥—Ä–æ–º—É –¥—ç–º–µ–Ω—Ü—ã—ñ –ø–∞–¥—á–∞—Å –Ω–µ–π—Ä–∞–ø—Å—ñ—Ö–∞–ª–∞–≥—ñ—á–Ω–∞–≥–∞ —Ç—ç—Å—Ü—ñ—Ä–∞–≤–∞–Ω–Ω—è. –î–ª—è –∫–∞–Ω—á–∞—Ç–∫–æ–≤–∞–≥–∞ –ø–∞—Ü–≤–µ—Ä–¥–∂–∞–Ω–Ω—è –¥—ã—è–≥–Ω–∞–∑—É –Ω–µ–∞–±—Ö–æ–¥–Ω—ã –≥—ñ—Å—Ç–∞–ø–∞—Ç–∞–ª–∞–≥—ñ—á–Ω—ã –∞–Ω–∞–ª—ñ–∑ —Ç–∫–∞–Ω–∞–∫ –º–æ–∑–≥–∞, –ø—Ä—ã—á—ã–º –ø–∞–¥—á–∞—Å –∑–≤–µ—Ä–∫—ñ –ø—Ä—ã–∂—ã—Ü—Ü—ë–≤—ã—Ö –¥—ã—è–≥–Ω–∞–∑–∞—û –ø–∞ –∫—Ä—ã—Ç—ç—Ä—ã—è—Ö –∑ –ø–∞—Å–º—è—Ä–æ—Ç–Ω—ã–º –∞–Ω–∞–ª—ñ–∑–∞–º –±—ã–ª—ñ –∞–¥–∑–Ω–∞—á–∞–Ω—ã –¥–æ–±—Ä–∞—è —Å—Ç–∞—Ç—ã—Å—Ç—ã—á–Ω–∞—è –Ω–∞–¥–∑–µ–π–Ω–∞—Å—Ü—å —ñ –ø—Ä–∞–≤—è—Ä–∞–ª—å–Ω–∞—Å—Ü—å[160]. –ù–∞–π—á–∞—Å—Ü–µ–π –ø–∞—Ä—É—à—ç–Ω–Ω—ñ –ø—Ä—ã —Ö–≤–∞—Ä–æ–±–µ –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ –∑–∞–∫—Ä–∞–Ω–∞—é—Ü—å –≤–æ—Å–µ–º –¥–∞–º–µ–Ω–∞—û: –ø–∞–º—è—Ü—å, –º–æ—û–Ω—ã—è –Ω–∞–≤—ã–∫—ñ, –∑–¥–æ–ª—å–Ω–∞—Å—Ü—å —É—Å–ø—Ä—ã–º–∞—Ü—å –Ω–∞–≤–∞–∫–æ–ª—å–Ω–∞–µ, –∫–∞–Ω—Å—Ç—Ä—É–∫—Ç—ã—û–Ω—ã—è –∑–¥–æ–ª—å–Ω–∞—Å—Ü—ñ, –∞—Ä—ã–µ–Ω—Ç–∞–≤–∞–Ω–Ω–µ —û –ø—Ä–∞—Å—Ç–æ—Ä—ã, —á–∞—Å–µ —ñ —û–ª–∞—Å–Ω–∞–π –∞—Å–æ–±–µ, –Ω–∞–≤—ã–∫—ñ –≤—ã—Ä–∞—à—ç–Ω–Ω—è –ø—Ä–∞–±–ª–µ–º, —Ñ—É–Ω–∫—Ü—ã—è–Ω–∞–≤–∞–Ω–Ω—è, —Å–∞–º–∞–∑–∞–±–µ—Å–ø—è—á—ç–Ω–Ω—è. –ì—ç—Ç—ã—è –¥–∞–º–µ–Ω—ã —ç–∫–≤—ñ–≤–∞–ª–µ–Ω—Ç–Ω—ã—è –∫—Ä—ã—Ç—ç—Ä—ã—è–º NINCDS-ADRDA, –ø–µ—Ä–∞–ª—ñ—á–∞–Ω—ã–º —É DSM-IV-TR[161][162]. –ú–µ—Ç–∞–¥—ã –¥—ã—è–≥–Ω–æ—Å—Ç—ã–∫—ñ  –ù–µ–π—Ä–∞–ø—Å—ñ—Ö–∞–ª–∞–≥—ñ—á–Ω—ã—è —Ç—ç—Å—Ç—ã, –Ω–∞–ø—Ä—ã–∫–ª–∞–¥, MMSE, —à—ã—Ä–æ–∫–∞ —û–∂—ã–≤–∞—é—Ü—Ü–∞ –¥–ª—è –∞—Ü—ç–Ω–∫—ñ –∫–∞–≥–Ω—ñ—Ç—ã—û–Ω—ã—Ö –ø–∞—Ä—É—à—ç–Ω–Ω—è—û, —è–∫—ñ—è –ø–∞–≤—ñ–Ω–Ω—ã –ø—Ä—ã—Å—É—Ç–Ω—ñ—á–∞—Ü—å –ø—Ä—ã –∑–∞—Ö–≤–æ—Ä–≤–∞–Ω–Ω—ñ. –î–ª—è –∞—Ç—Ä—ã–º–∞–Ω–Ω—è –Ω–∞–¥–∑–µ–π–Ω—ã—Ö –≤—ã–Ω—ñ–∫–∞—û –ø–∞—Ç—Ä–∞–±—É—é—Ü—Ü–∞ –±–æ–ª—å—à —Ä–∞–∑–≥–æ—Ä–Ω—É—Ç—ã—è –Ω–∞–±–æ—Ä—ã —Ç—ç—Å—Ç–∞—û, –∞—Å–∞–±–ª—ñ–≤–∞ –Ω–∞ –ø–∞—á–∞—Ç–∫–æ–≤—ã—Ö —Å—Ç–∞–¥—ã—è—Ö —Ö–≤–∞—Ä–æ–±—ã[163][164]. –£ –ø–∞—á–∞—Ç–∫—É —Ö–≤–∞—Ä–æ–±—ã –Ω–µ—û—Ä–∞–ª–∞–≥—ñ—á–Ω—ã –∞–≥–ª—è–¥ –∑–≤—ã—á–∞–π–Ω–∞ –Ω–µ –ø–∞–∫–∞–∑–≤–∞–µ –Ω—ñ—á–æ–≥–∞ –Ω–µ–∑–≤—ã—á–∞–π–Ω–∞–≥–∞, –∑–∞ –≤—ã–∫–ª—é—á—ç–Ω–Ω–µ–º —è—Å–∫—Ä–∞–≤—ã—Ö –∫–∞–≥–Ω—ñ—Ç—ã—û–Ω—ã—Ö –∞–¥—Ö—ñ–ª–µ–Ω–Ω—è—û, —è–∫—ñ—è –º–æ–≥—É—Ü—å –Ω–∞–≥–∞–¥–≤–∞—Ü—å –∑–≤—ã—á–∞–π–Ω—É—é –¥—ç–º–µ–Ω—Ü—ã—é. –ó –≥—ç—Ç–∞–π –ø—Ä—ã—á—ã–Ω—ã –¥–ª—è –¥—ã—Ñ–µ—Ä—ç–Ω—Ü—ã—è–ª—å–Ω–∞–π –¥—ã—è–≥–Ω–æ—Å—Ç—ã–∫—ñ —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ —ñ —ñ–Ω—à—ã—Ö –∑–∞—Ö–≤–æ—Ä–≤–∞–Ω–Ω—è—û –≤–∞–∂–Ω–∞–µ –ø–∞—à—ã—Ä–∞–Ω–∞–µ –Ω–µ—û—Ä–∞–ª–∞–≥—ñ—á–Ω–∞–µ –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω–µ[6]. –ì—É—Ç–∞—Ä–∫–∞ –∑ —á–ª–µ–Ω–∞–º—ñ —Å—è–º‚Äô—ñ —Ç–∞–∫—Å–∞–º–∞ –≤—ã–∫–∞—Ä—ã—Å—Ç–æ—û–≤–∞–µ—Ü—Ü–∞ –ø–∞–¥—á–∞—Å –∞—Ü—ç–Ω–∫—ñ —Ü—è—á—ç–Ω–Ω—è —Ö–≤–∞—Ä–æ–±—ã, –ø–∞–∫–æ–ª—å–∫—ñ —Å–≤–∞—è–∫—ñ –º–æ–≥—É—Ü—å –¥–∞—Ü—å –≤–∞–∂–Ω—É—é —ñ–Ω—Ñ–∞—Ä–º–∞—Ü—ã—é –∞–± —É–∑—Ä–æ—û–Ω—ñ —à—Ç–æ–¥–∑—ë–Ω–Ω–∞–π –∞–∫—Ç—ã—û–Ω–∞—Å—Ü—ñ —á–∞–ª–∞–≤–µ–∫–∞ —ñ –∞–± –ø–∞—Å—Ç—É–ø–æ–≤—ã–º –∑–Ω—ñ–∂—ç–Ω–Ω—ñ —è–≥–æ –∫–∞–≥–Ω—ñ—Ç—ã—û–Ω—ã—Ö –∑–¥–æ–ª—å–Ω–∞—Å—Ü–µ–π[165]. –£ —Ç–æ–π –∂–∞ –º–æ–º–∞–Ω—Ç, —É–≤–∞ –º–Ω–æ–≥—ñ—Ö –≤—ã–ø–∞–¥–∫–∞—Ö —Ä–∞–Ω–Ω—ñ—è —Å—ñ–º–ø—Ç–æ–º—ã –¥—ç–º–µ–Ω—Ü—ã—ñ –∑–∞—Å—Ç–∞—é—Ü—Ü–∞ –Ω–µ–∑–∞—û–≤–∞–∂–∞–Ω—ã–º—ñ —û —Å—è–º‚Äô—ñ —ñ —û—Ä–∞—á –∞—Ç—Ä—ã–º–æ—û–≤–∞–µ –∞–¥ —Å–≤–∞—è–∫–æ—û –Ω–µ–¥–∞–∫–ª–∞–¥–Ω—É—é —ñ–Ω—Ñ–∞—Ä–º–∞—Ü—ã—é[166]. –î–∞–¥–∞—Ç–∫–æ–≤—ã—è —Ç—ç—Å—Ç—ã —û–∑–±–∞–≥–∞—á–∞—é—Ü—å –∫–∞—Ä—Ü—ñ–Ω—É —ñ–Ω—Ñ–∞—Ä–º–∞—Ü—ã—è–π –ø—Ä–∞ –Ω–µ–∫–∞—Ç–æ—Ä—ã—è –∞—Å–ø–µ–∫—Ç—ã —Ö–≤–∞—Ä–æ–±—ã —ñ –¥–∞–∑–≤–∞–ª—è—é—Ü—å –≤—ã–∫–ª—é—á—ã—Ü—å —ñ–Ω—à—ã—è –¥—ã—è–≥–Ω–∞–∑—ã. –ê–Ω–∞–ª—ñ–∑ –∫—Ä—ã–≤—ñ –º–æ–∂–∞ –≤—ã—è–≤—ñ—Ü—å –∞–ª—å—Ç—ç—Ä–Ω–∞—Ç—ã—û–Ω—ã—è –ø—Ä—ã—á—ã–Ω—ã –¥—ç–º–µ–Ω—Ü—ã—ñ[6], —è–∫—ñ—è –∑—Ä—ç–¥–∫—É –Ω–∞–≤–∞—Ç –ø–∞–¥–¥–∞—é—Ü—Ü–∞ —Ç—ç—Ä–∞–ø—ñ—ñ, —è–∫–∞—è –Ω–∞–∫—ñ—Ä–æ—û–≤–∞–µ —Ä–∞–∑–≤—ñ—Ü—Ü—ë —Ö–≤–∞—Ä–æ–±—ã —û –∞–¥–≤–∞—Ä–æ—Ç–Ω—ã –±–æ–∫[167]. –¢–∞–∫—Å–∞–º–∞ —û–∂—ã–≤–∞—é—Ü—Ü–∞ –ø—Å—ñ—Ö–∞–ª–∞–≥—ñ—á–Ω—ã—è —Ç—ç—Å—Ç—ã –¥–ª—è –≤—ã—è—û–ª–µ–Ω–Ω—è –¥—ç–ø—Ä—ç—Å—ñ—ñ, —è–∫–∞—è –º–æ–∂–∞ —è–∫ —Å–ø–∞–¥–∞—Ä–æ–∂–Ω—ñ—á–∞—Ü—å —Ö–≤–∞—Ä–æ–±–µ –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞, –≥—ç—Ç–∞–∫ —ñ –∑‚Äô—è—û–ª—è—Ü—Ü–∞ –ø—Ä—ã—á—ã–Ω–∞–π –∫–∞–≥–Ω—ñ—Ç—ã—û–Ω–∞–≥–∞ –∑–Ω—ñ–∂—ç–Ω–Ω—è[168][169]. –ê–ø–∞—Ä–∞—Ç—É—Ä–∞ SPECT- —ñ PET-–≤—ñ–∑—É–∞–ª—ñ–∑–∞—Ü—ã—ñ –ø—Ä—ã —è–µ –¥–∞—Å—è–≥–∞–ª—å–Ω–∞—Å—Ü—ñ –º–æ–∂–∞ –±—ã—Ü—å –≤—ã–∫–∞—Ä—ã—Å—Ç–∞–Ω–∞ –¥–ª—è –ø–∞—Ü–≤–µ—Ä–¥–∂–∞–Ω–Ω—è –¥—ã—è–≥–Ω–∞–∑—É —Å—É–º–µ—Å–Ω–∞ –∑ —ñ–Ω—à—ã–º—ñ –º–µ—Ç–∞–¥–∞–º—ñ –∞—Ü—ç–Ω–∫—ñ, —è–∫—ñ—è —û–∫–ª—é—á–∞—é—Ü—å –∞–Ω–∞–ª—ñ–∑ –º–µ–Ω—Ç–∞–ª—å–Ω–∞–≥–∞ —Å—Ç–∞—Ç—É—Å—É[170]. –£ –ª—é–¥–∑–µ–π, —è–∫—ñ—è —û–∂–æ —Ö–≤–∞—Ä—ç—é—Ü—å –Ω–∞ –¥—ç–º–µ–Ω—Ü—ã—é, SPECT, –ø–∞ –Ω–µ–∫–∞—Ç–æ—Ä—ã—Ö –¥–∞–¥–∑–µ–Ω—ã—Ö, –¥–∞–∑–≤–∞–ª—è–µ –±–æ–ª—å—à —ç—Ñ–µ–∫—Ç—ã—û–Ω–∞ –¥—ã—Ñ–µ—Ä—ç–Ω—Ü—ã—è–≤–∞—Ü—å —Ö–≤–∞—Ä–æ–±—É –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ –∞–¥ —ñ–Ω—à—ã—Ö –ø—Ä—ã—á—ã–Ω —É –ø–∞—Ä–∞—û–Ω–∞–Ω–Ω—ñ —Å–∞ —Å—Ç–∞–Ω–¥–∞—Ä—Ç–Ω—ã–º —Ç—ç—Å—Ü—ñ—Ä–∞–≤–∞–Ω–Ω–µ–º —ñ —Ä–∞–∑–≥–ª—è–¥–∞–º –∞–Ω–∞–º–Ω–µ–∑—É[171]. –ú–∞–≥—á—ã–º–∞—Å—Ü—å –Ω–∞–∑—ñ—Ä–∞—Ü—å –∞–¥–∫–ª–∞–¥–∞–Ω–Ω—ñ –±—ç—Ç–∞-–∞–º—ñ–ª–æ—ñ–¥—É —û –º–æ–∑–≥—É –∂—ã–≤—ã—Ö –ª—é–¥–∑–µ–π –∑‚Äô—è–≤—ñ–ª–∞—Å—è –¥–∑—è–∫—É—é—á—ã —Å—Ç–≤–∞—Ä—ç–Ω–Ω—é —û –ü—ñ—Ç—Å–±—É—Ä–≥—Å–∫—ñ–º —É–Ω—ñ–≤–µ—Ä—Å—ñ—Ç—ç—Ü–µ –ü—ñ—Ç—Å–±—É—Ä–≥—Å–∫–∞–≥–∞ —Å–∞—Å—Ç–∞–≤—É B (PiB), —è–∫—ñ –∑–≤—è–∑–≤–∞–µ—Ü—Ü–∞ –∑ –∞–º—ñ–ª–æ—ñ–¥–Ω—ã–º—ñ –∞–¥–∫–ª–∞–¥–∞–Ω–Ω—è–º—ñ –ø—Ä—ã —û–≤—è–¥–∑–µ–Ω–Ω—ñ —û –∞—Ä–≥–∞–Ω—ñ–∑–º. –ö–∞—Ä–æ—Ç–∫–∞–∂—ã–≤—É—á—ã —Ä–∞–¥—ã—è–∞–∫—Ç—ã—û–Ω—ã —ñ–∑–∞—Ç–æ–ø –≤—É–≥–ª—è—Ä–æ–¥-11 —É –∑–ª—É—á—ç–Ω–Ω—ñ –¥–∞–∑–≤–∞–ª—è–µ –≤—ã–∑–Ω–∞—á—ã—Ü—å —Ä–∞–∑–º–µ—Ä–∫–∞–≤–∞–Ω–Ω–µ –≥—ç—Ç–∞–≥–∞ —Ä—ç—á—ã–≤–∞ —û –∞—Ä–≥–∞–Ω—ñ–∑–º–µ —ñ –∞—Ç—Ä—ã–º–∞—Ü—å –∫–∞—Ä—Ü—ñ–Ω—É –∞–º—ñ–ª–æ—ñ–¥–Ω—ã—Ö –∞–¥–∫–ª–∞–¥–∞–Ω–Ω—è—û —É –º–æ–∑–≥—É —Ö–≤–æ—Ä–∞–≥–∞ –∑ –¥–∞–ø–∞–º–æ–≥–∞–π –ü–≠–¢-—Å–∫–∞–Ω–µ—Ä–∞[172][173][174]. –ü–∞–∫–∞–∑–∞–Ω–∞ —Ç–∞–∫—Å–∞–º–∞, —à—Ç–æ –∞–±‚Äô–µ–∫—Ç—ã—û–Ω—ã–º –º–∞—Ä–∫–µ—Ä–∞–º —Ö–≤–∞—Ä–æ–±—ã –º–æ–∂–∞ –±—ã—Ü—å –∑–º—è—à—á—ç–Ω–Ω–µ –±—ç—Ç–∞-–∞–º—ñ–ª–æ—ñ–¥—É –∞–±–æ —Ç–∞—É-–±—è–ª–∫—É —û —Å–ø—ñ–Ω–Ω–∞–º–∞–∑–≥–∞–≤–æ–π –≤–∞–¥–∫–∞—Å—Ü—ñ[175]. –ì—ç—Ç—ã—è –¥–≤–∞ –Ω–æ–≤—ã—è –º–µ—Ç–∞–¥—ã –≤—ã–∫–ª—ñ–∫–∞–ª—ñ –ø—Ä–∞–ø–∞–Ω–æ–≤—ã –∞–± —Ä–∞—Å–ø—Ä–∞—Ü–æ—û—Ü—ã –Ω–æ–≤—ã—Ö –¥—ã—è–≥–Ω–∞—Å—Ç—ã—á–Ω—ã—Ö –∫—Ä—ã—Ç—ç—Ä—ã—è—û[6][159]. –õ—è—á—ç–Ω–Ω–µ–ü–∞–∫—É–ª—å —à—Ç–æ –∞–¥ —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ –Ω–µ–º–∞–≥—á—ã–º–∞ –≤—ã–ª–µ—á—ã—Ü—Ü–∞; –¥–∞—Å—Ç—É–ø–Ω—ã—è –º–µ—Ç–∞–¥—ã —Ç—ç—Ä–∞–ø—ñ—ñ –∑–¥–æ–ª—å–Ω—ã—è —û –Ω–µ–≤—è–ª—ñ–∫–∞–π —Å—Ç—É–ø–µ–Ω—ñ –ø–∞—û–ø–ª—ã–≤–∞—Ü—å –Ω–∞ —Å—ñ–º–ø—Ç–æ–º—ã, –∞–ª–µ –ø–∞ —Å–≤–∞—ë–π —Å—É—Ç–Ω–∞—Å—Ü—ñ –∑‚Äô—è—û–ª—è—é—Ü—Ü–∞ –ø–∞–ª—ñ—è—Ç—ã—û–Ω—ã–º—ñ –º–µ—Ä–∞–º—ñ. –ó —É—Å—è–≥–æ –∫–æ–º–ø–ª–µ–∫—Å—É –º–µ—Ä –º–æ–∂–Ω–∞ –≤—ã–ª—É—á—ã—Ü—å —Ñ–∞—Ä–º–∞–∫–∞–ª–∞–≥—ñ—á–Ω—ã—è, –ø—Å—ñ—Ö–∞—Å–∞—Ü—ã—è–ª—å–Ω—ã—è —ñ –º–µ—Ä—ã –ø–∞ –¥–æ–≥–ª—è–¥–∑–µ —Ö–≤–æ—Ä–∞–≥–∞. –§–∞—Ä–º–∞–∫–∞—Ç—ç—Ä–∞–ø—ñ—è  –Ý—ç–≥—É–ª—é—é—á—ã–º—ñ –∞–≥–µ–Ω—Ü—Ç–≤–∞–º—ñ, —Ç–∞–∫—ñ–º—ñ —è–∫ FDA —ñ EMEA, –∑–∞—Ä–∞–∑ —É—Ö–≤–∞–ª–µ–Ω—ã—è 4 –ø—Ä—ç–ø–∞—Ä–∞—Ç—ã –¥–ª—è —Ç—ç—Ä–∞–ø—ñ—ñ –∫–∞–≥–Ω—ñ—Ç—ã—û–Ω—ã—Ö –ø–∞—Ä—É—à—ç–Ω–Ω—è—û –ø—Ä—ã —Ö–≤–∞—Ä–æ–±–µ –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ ‚Äî 3 —ñ–Ω–≥—ñ–±—ñ—Ç–∞—Ä—ã —Ö–∞–ª—ñ–Ω—ç—Å—Ç—ç—Ä–∞–∑—ã —ñ –º–µ–º–∞–Ω—Ü—ñ–Ω (NMDA-–∞–Ω—Ç–∞–≥–∞–Ω—ñ—Å—Ç). –ü—Ä—ã –≥—ç—Ç—ã–º –Ω—è–º–∞ —Ç–∞–∫—ñ—Ö –ª–µ–∫–∞—û, —Å—è—Ä–æ–¥ –¥–∑–µ—è–Ω–Ω—è—û —è–∫—ñ—Ö –±—ã–ª–æ –±—ã –ø–∞–∑–Ω–∞—á–∞–Ω–∞ –∑–∞–ø–∞–≤–æ–ª—å–≤–∞–Ω–Ω–µ –∞–±–æ —Å–ø—ã–Ω–µ–Ω–Ω–µ —Ä–∞–∑–≤—ñ—Ü—Ü—è —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞. –í—è–¥–æ–º–∞–π –ø—Ä—ã–∫–º–µ—Ç–∞–π —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ –∑‚Äô—è—û–ª—è–µ—Ü—Ü–∞ –ø–∞–Ω—ñ–∂—ç–Ω–Ω–µ –∞–∫—Ç—ã—û–Ω–∞—Å—Ü—ñ —Ö–∞–ª—ñ–Ω–µ—Ä–≥—ñ—á–Ω—ã—Ö –Ω–µ–π—Ä–æ–Ω–∞—û[176]. –Ü–Ω–≥—ñ–±—ñ—Ç–∞—Ä—ã —Ö–∞–ª—ñ–Ω—ç—Å—Ç—ç—Ä–∞–∑—ã –∑–Ω—ñ–∂–∞—é—Ü—å —Ö—É—Ç–∫–∞—Å—Ü—å —Ä–∞–∑–±—É—Ä—ç–Ω–Ω—è –∞—Ü—ç—Ç—ã–ª—Ö–∞–ª—ñ–Ω—É (ACh), –ø–∞–≤—ã—à–∞—é—á—ã —è–≥–æ –∫–∞–Ω—Ü—ç–Ω—Ç—Ä–∞—Ü—ã—é —û –º–æ–∑–≥—É —ñ –∫–∞–º–ø–µ–Ω—Å—É—é—á—ã —Å—Ç—Ä–∞—Ç—É ACh, —è–∫–∞—è, —É —Å–≤–∞—é —á–∞—Ä–≥—É, –≤—ã–∫–ª—ñ–∫–∞–µ—Ü—Ü–∞ —Å—Ç—Ä–∞—Ç–∞–π —Ö–∞–ª—ñ–Ω–µ—Ä–≥—ñ—á–Ω—ã—Ö –Ω–µ–π—Ä–æ–Ω–∞—û[177]. –ü–∞ —Å—Ç–∞–Ω–µ –Ω–∞ 2008 –≥–æ–¥, —É—Ä–∞—á–∞–º—ñ –≤—ã–∫–∞—Ä—ã—Å—Ç–æ—û–≤–∞–ª—ñ—Å—è —Ç–∞–∫—ñ—è ACh-—ñ–Ω–≥—ñ–±—ñ—Ç–∞—Ä—ã, —è–∫ –¥–∞–Ω–µ–ø–µ–∑—ñ–ª[178], –≥–∞–ª–∞–Ω—Ç–∞–º—ñ–Ω[179] —ñ —Ä—ã–≤–∞—Å—Ç—ã–≥–º—ñ–Ω (—É —Ñ–æ—Ä–º–µ —Ç–∞–±–ª–µ—Ç–∞–∫[180] —ñ –ø–ª–∞—Å—Ç—ã—Ä—É[181]). –Å—Å—Ü—å —Å–≤–µ–¥—á–∞–Ω–Ω—ñ —ç—Ñ–µ–∫—Ç—ã—û–Ω–∞—Å—Ü—ñ –≥—ç—Ç—ã—Ö –ø—Ä—ç–ø–∞—Ä–∞—Ç–∞—û –Ω–∞ –ø–∞—á–∞—Ç–∫–æ–≤–∞–π —ñ —û–º–µ—Ä–∞–Ω–∞–π —Å—Ç–∞–¥—ã—è—Ö[182], –∞ —Ç–∞–∫—Å–∞–º–∞ –Ω–µ–∫–∞—Ç–æ—Ä—ã—è –ø–∞–¥—Å—Ç–∞–≤—ã –¥–ª—è —û–∂—ã–≤–∞–Ω–Ω—è —ñ—Ö –Ω–∞ –ø–æ–∑–Ω—è–π —Å—Ç–∞–¥—ã—ñ. –¢–æ–ª—å–∫—ñ –¥–∞–Ω–µ–ø–µ–∑—ñ–ª —É—Ö–≤–∞–ª–µ–Ω—ã –¥–∞ —û–∂—ã–≤–∞–Ω–Ω—è –ø—Ä—ã –Ω–∞–¥—ã—Ö–æ–¥–∑–µ —Ü—è–∂–∫–∞–π –¥—ç–º–µ–Ω—Ü—ã—ñ[183]. –í—ã–∫–∞—Ä—ã—Å—Ç–∞–Ω–Ω–µ –≥—ç—Ç—ã—Ö –ø—Ä—ç–ø–∞—Ä–∞—Ç–∞—û –ø—Ä—ã –º—è–∫–∫—ñ–º –∫–∞–≥–Ω—ñ—Ç—ã—û–Ω—ã–º –ø–∞—Ä—É—à—ç–Ω–Ω—ñ –Ω–µ –∑–∞–ø–∞–≤–æ–ª—ñ–ª–∞ –Ω–∞–¥—ã—Ö–æ–¥—É —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞[184]. –°—è—Ä–æ–¥ –ø–∞–±–æ—á–Ω—ã—Ö —ç—Ñ–µ–∫—Ç–∞—û –ø—Ä—ç–ø–∞—Ä–∞—Ç–∞—û —Å–∞–º—ã–º—ñ —Ä–∞—Å–ø–∞—û—Å—é–¥–∂–∞–Ω—ã–º—ñ –∑‚Äô—è—û–ª—è—é—Ü—Ü–∞ –ø–∞—á—É—Ü—Ü—ë –Ω—É–¥–∑—ñ —ñ –≤–∞–Ω—ñ—Ç—ã, —è–∫—ñ—è –∑–≤—è–∑–∞–Ω—ã—è –∑ –ª—ñ—à–∫–∞–º —Ö–∞–ª—ñ–Ω–µ—Ä–≥—ñ—á–Ω–∞–π –∞–∫—Ç—ã—û–Ω–∞—Å—Ü—ñ; —è–Ω—ã —û–∑–Ω—ñ–∫–∞—é—Ü—å —É 1 % ‚Äî 10 % –ø–∞—Ü—ã–µ–Ω—Ç–∞—û —ñ –º–æ–≥—É—Ü—å –±—ã—Ü—å —Å–ª–∞–±–∞- –∞–±–æ —û–º–µ—Ä–∞–Ω–∞–≤—ã–∫–∞–∑–∞–Ω—ã–º—ñ. –Ý–∞–¥–∑–µ–π —Å—É—Å—Ç—Ä–∞–∫–∞—é—Ü—Ü–∞ —Å–ø–∞–∑–º—ã —Ü—è–≥–ª—ñ—Ü, –±—Ä–∞–¥—ã–∫–∞—Ä–¥—ã—è, –∑–Ω—ñ–∂—ç–Ω–Ω–µ –∞–ø–µ—Ç—ã—Ç—É, —Å—Ç—Ä–∞—Ç–∞ –≤–∞–≥—ñ, –ø–∞–≤–µ–ª—ñ—á—ç–Ω–Ω–µ –∫—ñ—Å–ª–æ—Ç–Ω–∞—Å—Ü—ñ —Å—Ç—Ä–∞—û–Ω—ñ–∫–∞–≤–∞–≥–∞ —Å–æ–∫—É[185][186][187][188][189]. –£–∑–±—É–¥–∂–∞–ª—å–Ω—ã –Ω–µ–π—Ä–∞—Ç—Ä–∞–Ω—Å–º—ñ—Ç–∞—Ä –≥–ª—É—Ç–∞–º–∞—Ç —ñ–≥—Ä–∞–µ –≤–∞–∂–Ω—É—é —Ä–æ–ª—é —û –ø—Ä–∞—Ü—ã –Ω–µ—Ä–≤–æ–≤–∞–π —Å—ñ—Å—Ç—ç–º—ã, –∞–ª–µ —è–≥–æ –ª—ñ—à–∞–∫ –≤—è–¥–∑–µ –¥–∞ –ø—Ä–∞–∑–º–µ—Ä–Ω–∞–π –∞–∫—Ç—ã–≤–∞—Ü—ã—ñ –≥–ª—É—Ç–∞–º–∞—Ç–Ω—ã—Ö —Ä—ç—Ü—ç–ø—Ç–∞—Ä–∞—û —ñ –º–æ–∂–∞ –≤—ã–∫–ª—ñ–∫–∞—Ü—å –≥—ñ–±–µ–ª—å –∫–ª–µ—Ç–∞–∫. –ì—ç—Ç—ã –ø—Ä–∞—Ü—ç—Å, —è–∫—ñ –Ω–∞–∑—ã–≤–∞–µ—Ü—Ü–∞ —ç–∫—Å–∞–π—Ç–∞—Ç–∞–∫—Å—ñ—á–Ω–∞—Å—Ü—é, –∞–¥–∑–Ω–∞—á–∞–µ—Ü—Ü–∞ –Ω–µ —Ç–æ–ª—å–∫—ñ –ø—Ä—ã —Ö–≤–∞—Ä–æ–±–µ –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞, –∞–ª–µ —ñ –ø—Ä—ã —ñ–Ω—à—ã—Ö —Å—Ç–∞–Ω–∞—Ö, –Ω–∞–ø—Ä—ã–∫–ª–∞–¥, –ø—Ä—ã —Ö–≤–∞—Ä–æ–±–µ –ü–∞—Ä–∫—ñ–Ω—Å–æ–Ω–∞ —ñ —Ä–∞—Å—Å–µ—è–Ω—ã–º —Å–∫–ª–µ—Ä–æ–∑–µ[190]. –ü—Ä—ç–ø–∞—Ä–∞—Ç –ø–∞–¥ –Ω–∞–∑–≤–∞–π –º–µ–º–∞–Ω—Ü—ñ–Ω[191], —è–∫—ñ –ø–µ—Ä—à–∞–ø–∞—á–∞—Ç–∫–æ–≤–∞ —û–∂—ã–≤–∞—û—Å—è –¥–ª—è –ª—è—á—ç–Ω–Ω—è –≥—Ä—ã–ø—É, —ñ–Ω–≥—ñ–±—ñ—Ä—É–µ –∞–∫—Ç—ã–≤–∞—Ü—ã—é –≥–ª—É—Ç–∞–º–∞—Ç–Ω—ã—Ö NMDA-—Ä—ç—Ü—ç–ø—Ç–∞—Ä–∞—û[190]. –ü–∞–∫–∞–∑–∞–Ω–∞ —û–º–µ—Ä–∞–Ω–∞—è —ç—Ñ–µ–∫—Ç—ã—û–Ω–∞—Å—Ü—å –º–µ–º–∞–Ω—Ü—ñ–Ω—É –ø—Ä—ã —Ö–≤–∞—Ä–æ–±–µ –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ —û–º–µ—Ä–∞–Ω–∞–π —ñ –º–æ—Ü–Ω–∞–π —Ü—è–∂–∫–∞—Å—Ü—ñ, –∞–ª–µ –Ω–µ–≤—è–¥–æ–º–∞, —è–∫ —ë–Ω –¥–∑–µ–π–Ω—ñ—á–∞–µ –Ω–∞ —Ä–∞–Ω–Ω—è–π —Å—Ç–∞–¥—ã—ñ[192]. –Ý—ç–¥–∫–∞ –∞–¥–∑–Ω–∞—á–∞—é—Ü—Ü–∞ —Å–ª–∞–±–∞–≤—ã–∫–∞–∑–∞–Ω—ã—è –ø–∞–±–æ—á–Ω—ã—è —ç—Ñ–µ–∫—Ç—ã, —Å—è—Ä–æ–¥ —ñ—Ö ‚Äî –∞–º–∞—Ä–æ–∫—ñ, –∑–∞–º—è—à–∞–Ω–Ω–µ, –∑–∞–≤–∞—Ä–æ—Ç –≥–∞–ª–∞–≤—ã, –≥–∞–ª–∞—û–Ω—ã –±–æ–ª—å —ñ –∑–º–æ—Ä–∞[193]. –£ –∫–∞–º–±—ñ–Ω–∞—Ü—ã—ñ –∑ –¥–∞–Ω–µ–ø–µ–∑—ñ–ª–∞–º –º–µ–º–∞–Ω—Ü—ñ–Ω –¥—ç–º–∞–Ω—Å—Ç—Ä—É–µ ¬´—Å—Ç–∞—Ç—ã—Å—Ç—ã—á–Ω–∞ –∑–Ω–∞—á–Ω—É—é, –∞–ª–µ –∫–ª—ñ–Ω—ñ—á–Ω–∞ –ª–µ–¥–∑—å–≤–µ –∑–∞—û–≤–∞–∂–Ω—É—é —ç—Ñ–µ–∫—Ç—ã—û–Ω–∞—ŗܗ嬪 —É –¥–∑–µ—è–Ω–Ω—ñ –Ω–∞ –∫–∞–≥–Ω—ñ—Ç—ã—û–Ω—ã—è –ø–∞–∫–∞–∑—á—ã–∫—ñ[194]. –£ –ø–∞—Ü—ã–µ–Ω—Ç–∞—û, —á—ã—è –ø–∞–≤–æ–¥–∑—ñ–Ω—ã —û—è—û–ª—è—é—Ü—å –ø—Ä–∞–±–ª–µ–º—É, –∞–Ω—Ç—ã–ø—Å—ñ—Ö–æ—Ç—ã–∫—ñ –º–æ–≥—É—Ü—å –≤–∞ —û–º–µ—Ä–∞–Ω–∞–π —Å—Ç—É–ø–µ–Ω—ñ –∑–Ω—ñ–∑—ñ—Ü—å –∞–≥—Ä—ç—Å—ñ—é —ñ —û–∑–¥–∑–µ–π–Ω—ñ—á–∞—Ü—å –Ω–∞ –ø—Å—ñ—Ö–æ–∑. –£ —Ç–æ–π –∂–∞ —á–∞—Å –≥—ç—Ç—ã—è –ø—Ä—ç–ø–∞—Ä–∞—Ç—ã –≤—ã–∫–ª—ñ–∫–∞—é—Ü—å —Å—É—Ä‚Äô—ë–∑–Ω—ã—è –ø–∞–±–æ—á–Ω—ã—è —ç—Ñ–µ–∫—Ç—ã, —É –ø—Ä—ã–≤–∞—Ç–Ω–∞—Å—Ü—ñ, —Ü—ç—Ä—ç–±—Ä–∞–≤–∞—Å–∫—É–ª—è—Ä–Ω—ã—è —û—Å–∫–ª–∞–¥–Ω–µ–Ω–Ω—ñ, —Ä—É—Ö–∞–ª—å–Ω—ã—è —Ä–∞–∑–ª–∞–¥—ã —ñ –∑–Ω—ñ–∂—ç–Ω–Ω–µ –∫–∞–≥–Ω—ñ—Ç—ã—û–Ω—ã—Ö –∑–¥–æ–ª—å–Ω–∞—Å—Ü–µ–π, —à—Ç–æ –≤—ã–∫–ª—é—á–∞–µ —ñ—Ö —à—Ç–æ–¥–∑—ë–Ω–Ω–∞–µ –≤—ã–∫–∞—Ä—ã—Å—Ç–∞–Ω–Ω–µ[195][196][197][198]. –ü—Ä—ã –¥–æ—û–≥—ñ–º –ø—Ä—ã–∑–Ω–∞—á—ç–Ω–Ω—ñ –∞–Ω—Ç—ã–ø—Å—ñ—Ö–æ—Ç—ã–∫–∞—û –ø—Ä—ã —Ö–≤–∞—Ä–æ–±–µ –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ –∞–¥–∑–Ω–∞—á–∞–µ—Ü—Ü–∞ –ø–∞–≤—ã—à–∞–Ω–∞—è —Å–º—è—Ä–æ—Ç–Ω–∞—Å—Ü—å[198]. –ü—Å—ñ—Ö–∞—Å–∞—Ü—ã—è–ª—å–Ω–∞–µ —û–º—è—à–∞–Ω–Ω–µ –ü—Å—ñ—Ö–∞—Å–∞—Ü—ã—è–ª—å–Ω–∞–µ —û–º—è—à–∞–Ω–Ω–µ –¥–∞–ø–∞—û–Ω—è–µ —Ñ–∞—Ä–º–∞–∫–∞–ª–∞–≥—ñ—á–Ω–∞–µ —ñ –º–æ–∂–∞ –±—ã—Ü—å –ø–∞–¥–∑–µ–ª–µ–Ω–∞–µ –Ω–∞ –Ω–∞—Å—Ç—É–ø–Ω—ã—è –ø–∞–¥—ã—Ö–æ–¥—ã:
–≠—Ñ–µ–∫—Ç—ã—û–Ω–∞—Å—Ü—å —É–º—è—à–∞–Ω–Ω—è –ø–∞–∫—É–ª—å –Ω–µ –∞—Å–≤–µ—Ç–ª–µ–Ω–∞ —û –Ω–∞–≤—É–∫–æ–≤–∞–π –ª—ñ—Ç–∞—Ä–∞—Ç—É—Ä—ã, –¥–∞ —Ç–∞–≥–æ –∂ —Å–∞–º –ø–∞–¥—ã—Ö–æ–¥ —Ä–∞—Å–ø–∞—û—Å—é–¥–∂–≤–∞–µ—Ü—Ü–∞ –Ω–µ –Ω–∞ —Ö–≤–∞—Ä–æ–±—É –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞, –∞ –Ω–∞ –¥—ç–º–µ–Ω—Ü—ã—é —û —Ü—ç–ª—ã–º[199]. –ü–∞–≤–æ–¥–∑—ñ–Ω–Ω–∞–µ —û–º—è—à–∞–Ω–Ω–µ –Ω–∞–∫—ñ—Ä–∞–≤–∞–Ω–∞–µ –Ω–∞ –≤—ã–∑–Ω–∞—á—ç–Ω–Ω–µ –ø–µ—Ä–∞–¥—É–º–æ—û —ñ –Ω–∞—Å—Ç—É–ø—Å—Ç–≤–∞—û –ø—Ä–∞–±–ª–µ–º–Ω—ã—Ö –ø–∞–≤–æ–¥–∑—ñ–Ω —ñ –ø—Ä–∞—Ü—É –ø–∞ —ñ—Ö –∫–∞—Ä—ç–∫—Ü—ã—ñ. –ü—Ä—ã –≤—ã–∫–∞—Ä—ã—Å—Ç–∞–Ω–Ω—ñ –≥—ç—Ç–∞–≥–∞ –ø–∞–¥—ã—Ö–æ–¥—É –Ω–µ –∞–¥–∑–Ω–∞—á–∞–Ω–∞ –ø–∞–ª—è–ø—à—ç–Ω–Ω—è –∞–≥—É–ª—å–Ω–∞–≥–∞ —û–∑—Ä–æ—û–Ω—é —Ñ—É–Ω–∫—Ü—ã—è–Ω–∞–≤–∞–Ω–Ω—è[200], –∞–ª–µ –º–∞–≥—á—ã–º–∞ –∑–º—è–≥—á—ç–Ω–Ω–µ –∞—Å–æ–±–Ω—ã—Ö –ø—Ä–∞–±–ª–µ–º, —Ç–∞–∫—ñ—Ö —è–∫ –Ω–µ—Ç—Ä—ã–º–∞–Ω–Ω–µ –º–∞—á—ã[201]. –ê–¥–Ω–æ—Å–Ω–∞ —û–∑–¥–∑–µ—è–Ω–Ω—è –º–µ—Ç–æ–¥—ã–∫ –≥—ç—Ç–∞–≥–∞ –∫—ñ—Ä—É–Ω–∫—É –Ω–∞ —ñ–Ω—à—ã—è –ø–∞–≤–æ–¥–∑—ñ–Ω–Ω—ã—è –∞–¥—Ö—ñ–ª–µ–Ω–Ω—ñ, —è–∫, –Ω–∞–ø—Ä—ã–∫–ª–∞–¥, –±–∞–¥–∑—è–∂–Ω—ñ—Ü—Ç–≤–∞, –Ω–µ –Ω–∞–∑–∞–ø–∞—à–∞–Ω–∞ –¥–∞—Å—Ç–∞—Ç–∫–æ–≤–∞ —è–∫–∞—Å–Ω—ã—Ö –¥–∞–¥–∑–µ–Ω—ã—Ö[202][203]. –£–º—è—à–∞–Ω–Ω—ñ, —è–∫—ñ—è –∑–∞–∫—Ä–∞–Ω–∞—é—Ü—å —ç–º–∞—Ü—ã—è–Ω–∞–ª—å–Ω—É—é —Å—Ñ–µ—Ä—É, —É–∫–ª—é—á–∞—é—Ü—å —É —Å—è–±–µ —Ç—ç—Ä–∞–ø—ñ—é —û—Å–ø–∞–º—ñ–Ω–∞–º—ñ (–∞–Ω–≥–ª.: reminiscence therapy, RT), –≤–∞–ª—ñ–¥–∞—Ü—ã–π–Ω—É—é —Ç—ç—Ä–∞–ø—ñ—é, –ø–∞–¥—Ç—Ä—ã–º–ª—ñ–≤–∞—é—á—É—é –ø—Å—ñ—Ö–∞—Ç—ç—Ä–∞–ø—ñ—é, —Å–µ–Ω—Å–æ—Ä–Ω—É—é —ñ–Ω—Ç—ç–≥—Ä–∞—Ü—ã—é (¬´—Å–Ω—É–∑–µ–ª–µ–Ω¬ª) —ñ ¬´—Å—ñ–º—É–ª—è—Ü—ã—é –ø—Ä—ã—Å—É—Ç–Ω–∞—Å—Ü—ñ¬ª (–∞–Ω–≥–ª.: simulated presence therapy, SPT). –ü–∞–¥—Ç—Ä—ã–º–ª—ñ–≤–∞—é—á–∞—è –ø—Å—ñ—Ö–∞—Ç—ç—Ä–∞–ø—ñ—è –∞–º–∞–ª—å –Ω–µ –¥–∞—Å–ª–µ–¥–∞–≤–∞–ª–∞—Å—è –Ω–∞–≤—É–∫–æ–≤—ã–º—ñ –º–µ—Ç–∞–¥–∞–º—ñ, –∞–ª–µ –Ω–µ–∫–∞—Ç–æ—Ä—ã—è –∫–ª—ñ–Ω—ñ—á–Ω—ã—è —Å—É–ø—Ä–∞—Ü–æ—û–Ω—ñ–∫—ñ –ª—ñ—á–∞—Ü—å, —à—Ç–æ —è–Ω–∞ –¥–∞–µ –∫–∞—Ä—ã—Å—Ü—å –ø—Ä–∞ —Å–ø—Ä–æ–±–µ –¥–∞–ø–∞–º–∞–≥—á—ã –ª—ë–≥–∫–∞ —Ö–≤–æ—Ä—ã–º –ø–∞—Ü—ã–µ–Ω—Ç–∞–º –∞–¥–∞–ø—Ç–∞–≤–∞—Ü—Ü–∞ –¥–∞ –∑–∞—Ö–≤–æ—Ä–≤–∞–Ω–Ω—è[199]. –ü—Ä—ã —Ç—ç—Ä–∞–ø—ñ—ñ —û—Å–ø–∞–º—ñ–Ω–∞–º—ñ (RT) –ø–∞—Ü—ã–µ–Ω—Ç—ã –∞–±–º—è—Ä–∫–æ—û–≤–∞—é—Ü—å –ø–µ—Ä–∞–∂—ã—Ç—ã—è —ñ–º—ñ –ø–∞–¥–∑–µ—ñ —Å–∞–º –Ω–∞—Å–∞–º –∑ —Ç—ç—Ä–∞–ø–µ—û—Ç–∞–º –∞–±–æ —û –≥—Ä—É–ø–µ, —á–∞—Å—Ç–∞ –∑ –≤—ã–∫–∞—Ä—ã—Å—Ç–∞–Ω–Ω–µ–º —Ñ–∞—Ç–∞–≥—Ä–∞—Ñ—ñ–π, –ø—Ä–∞–¥–º–µ—Ç–∞—û —Ö–∞—Ç–Ω—è–≥–∞ —û–∂—ã—Ç–∫—É, —Å—Ç–∞—Ä—ã—Ö –º—É–∑—ã–∫–∞–ª—å–Ω—ã—Ö —ñ –∞—Ä—Ö—ñ—û–Ω—ã—Ö –∞—û–¥—ã—ë–∑–∞–ø—ñ—Å–∞—û —ñ —ñ–Ω—à—ã—Ö –∑–Ω–∞—ë–º—ã—Ö –ø—Ä–∞–¥–º–µ—Ç–∞—û –∑ –º—ñ–Ω—É–ª–∞–≥–∞. –•–∞—Ü—è –∫–æ–ª—å–∫–∞—Å—Ü—å —è–∫–∞—Å–Ω—ã—Ö –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω—è—û —ç—Ñ–µ–∫—Ç—ã—û–Ω–∞—Å—Ü—ñ RT –Ω–µ–≤—è–ª—ñ–∫–∞—è, –º–∞–≥—á—ã–º–∞–µ —Å—Ç–∞–Ω–æ—û—á–∞–µ —û–∑–¥–∑–µ—è–Ω–Ω–µ –≥—ç—Ç–∞–≥–∞ –º–µ—Ç–∞–¥—É –Ω–∞ –º—ã—Å–ª–µ–Ω–Ω–µ —ñ –Ω–∞—Å—Ç—Ä–æ–π –ø–∞—Ü—ã–µ–Ω—Ç–∞[204]. –°—ñ–º—É–ª—è—Ü—ã—è –ø—Ä—ã—Å—É—Ç–Ω–∞—Å—Ü—ñ, —è–∫–∞—è –≥—Ä—É–Ω—Ç—É–µ—Ü—Ü–∞ –Ω–∞ —Ç—ç–æ—Ä—ã—è—Ö –ø—Ä—ã–≤—è–∑–∞–Ω–∞—Å—Ü—ñ, –º–∞–µ –ø–∞–¥ —Å–∞–±–æ–π –ø—Ä–∞–π–≥—Ä–∞–≤–∞–Ω–Ω–µ –∞—û–¥—ã—ë–∑–∞–ø—ñ—Å–∞—û –∑ –≥–∞–ª–∞—Å–∞–º—ñ –Ω–∞–π–±–ª—ñ–∂—ç–π—à—ã—Ö —Å–≤–∞—è–∫–æ—û. –ü–∞ –ø–∞–ø—è—Ä—ç–¥–Ω—ñ—Ö –¥–∞–¥–∑–µ–Ω—ã—Ö, —É –ø–∞—Ü—ã–µ–Ω—Ç–∞—û, —è–∫—ñ—è –ø—Ä–∞—Ö–æ–¥–∑—è—Ü—å –∫—É—Ä—Å SRT, –∑–Ω—ñ–∂–∞–µ—Ü—Ü–∞ —û–∑—Ä–æ–≤–µ–Ω—å —Ç—Ä—ã–≤–æ–∂–Ω–∞—Å—Ü—ñ, –ø–∞–≤–æ–¥–∑—ñ–Ω—ã —Å—Ç–∞–Ω–æ–≤—è—Ü—Ü–∞ –±–æ–ª—å—à —Å–ø–∞–∫–æ–π–Ω—ã–º—ñ[205][206]. –í–∞–ª—ñ–¥–∞—Ü—ã–π–Ω–∞—è —Ç—ç—Ä–∞–ø—ñ—è –≥—Ä—É–Ω—Ç—É–µ—Ü—Ü–∞ –Ω–∞ –ø—Ä—ã–∑–Ω–∞–Ω–Ω—ñ —Ä—ç—á–∞—ñ—Å–Ω–∞—Å—Ü—ñ —ñ –ø–µ—Ä—Å–∞–Ω–∞–ª—å–Ω–∞–π –ø—Ä–∞—û–¥—ã –ø–µ—Ä–∞–∂—ã–≤–∞–Ω–Ω—è—û —ñ–Ω—à–∞–≥–∞ —á–∞–ª–∞–≤–µ–∫–∞, –∞ –Ω–∞ —Å–µ–∞–Ω—Å–∞—Ö —Å–µ–Ω—Å–æ—Ä–Ω–∞–π —ñ–Ω—Ç—ç–≥—Ä–∞—Ü—ã—ñ –ø–∞—Ü—ã–µ–Ω—Ç –≤—ã–∫–æ–Ω–≤–∞–µ –ø—Ä–∞–∫—Ç—ã–∫–∞–≤–∞–Ω–Ω—ñ, –ø–∞–∫–ª—ñ–∫–∞–Ω—ã—è —Å—Ç—ã–º—É–ª—è–≤–∞—Ü—å –æ—Ä–≥–∞–Ω—ã –ø–∞—á—É—Ü—Ü—è—û. –î–∞–¥–∑–µ–Ω—ã—Ö —É –ø–∞–¥—Ç—Ä—ã–º–∫—É –≥—ç—Ç—ã—Ö –¥–≤—É—Ö –º–µ—Ç–∞–¥–∞—û –Ω—è–º–Ω–æ–≥–∞[207][208]. –ê—Ä—ã–µ–Ω—Ç–∞–≤–∞–Ω–Ω–µ —û —Ä—ç–∞–ª—å–Ω–∞—Å—Ü—ñ, –∫–∞–≥–Ω—ñ—Ç—ã—û–Ω–∞—è –ø–µ—Ä–∞–ø–∞–¥—Ä—ã—Ö—Ç–æ—û–∫–∞ —ñ —ñ–Ω—à—ã—è –∫–∞–≥–Ω—ñ—Ç—ã—û–Ω–∞-–∞—Ä—ã–µ–Ω—Ç–∞–≤–∞–Ω—ã—è –º–µ—Ç–∞–¥—ã —Ç—ç—Ä–∞–ø—ñ—ñ —û–∂—ã–≤–∞—é—Ü—Ü–∞ –∑ –º—ç—Ç–∞–π –∑–Ω—ñ–∑—ñ—Ü—å –∫–∞–≥–Ω—ñ—Ç—ã—û–Ω—ã –¥—ç—Ñ—ñ—Ü—ã—Ç. –ê—Ä—ã–µ–Ω—Ç–∞–≤–∞–Ω–Ω–µ —û —Ä—ç–∞–ª—å–Ω–∞—Å—Ü—ñ –∑–∞–∫–ª—é—á–∞–µ—Ü—Ü–∞ —û –ø—Ä–∞–¥—Å—Ç–∞—û–ª–µ–Ω–Ω—ñ —ñ–Ω—Ñ–∞—Ä–º–∞—Ü—ã—ñ –∞–± —á–∞—Å–µ, –º–µ—Å—Ü–∞–∑–Ω–∞—Ö–æ–¥–∂–∞–Ω–Ω—ñ —ñ –∞—Å–æ–±–µ –ø–∞—Ü—ã–µ–Ω—Ç–∞ –¥–ª—è —Ç–∞–≥–æ, –∫–∞–± –ø–∞–ª–µ–≥—á—ã—Ü—å —É—Å–≤–µ–¥–∞–º–ª–µ–Ω–Ω–µ —ñ–º –∞—Å—è—Ä–æ–¥–¥–∑—è —ñ —û–ª–∞—Å–Ω–∞–≥–∞ –º–µ—Å—Ü–∞ —û —ñ–º. –£ —Å–≤–∞—é —á–∞—Ä–≥—É, –∫–∞–≥–Ω—ñ—Ç—ã—û–Ω–∞—è –ø–µ—Ä–∞–ø–∞–¥—Ä—ã—Ö—Ç–æ—û–∫–∞ –ø—Ä–∞–≤–æ–¥–∑—ñ—Ü—Ü–∞ –¥–ª—è –ø–∞–ª—è–ø—à—ç–Ω–Ω—è –ø–∞—Ä—É—à–∞–Ω—ã—Ö –∑–¥–æ–ª—å–Ω–∞—Å—Ü–µ–π —Ö–≤–æ—Ä–∞–≥–∞, —è–∫–æ–º—É –¥–∞—é—Ü—å –∑–∞–¥–∞—á—ã, —è–∫—ñ—è –ø–∞—Ç—Ä–∞–±—É—é—Ü—å —Ä–∞–∑—É–º–æ–≤–∞–≥–∞ –Ω–∞–ø—Ä—É–∂–∞–Ω–Ω—è. –ê–¥–∑–Ω–∞—á–∞–Ω–∞ –Ω–µ–∫–∞—Ç–æ—Ä–∞–µ –ø–∞–ª—è–ø—à—ç–Ω–Ω–µ –∫–∞–≥–Ω—ñ—Ç—ã—û–Ω—ã—Ö –º–∞–≥—á—ã–º–∞—Å—Ü–µ–π –ø—Ä—ã –≤—ã–∫–∞—Ä—ã—Å—Ç–∞–Ω–Ω—ñ —è–∫ –ø–µ—Ä—à–∞–≥–∞, –≥—ç—Ç–∞–∫ —ñ –¥—Ä—É–≥–æ–≥–∞ –º–µ—Ç–∞–¥—É[209][210], –∞–¥–Ω–∞–∫ —É –Ω–µ–∫–∞—Ç–æ—Ä—ã—Ö –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω—è—Ö –≥—ç—Ç—ã —ç—Ñ–µ–∫—Ç –∑ —Ü—è–≥–∞–º —á–∞—Å—É –∑–Ω—ñ–∫–∞—û —ñ –±—ã–ª—ñ –∞–¥–∑–Ω–∞—á–∞–Ω—ã –Ω–µ–≥–∞—Ç—ã—û–Ω—ã—è –ø—Ä–∞—è–≤—ã, –Ω–∞–ø—Ä—ã–∫–ª–∞–¥, —Ä–∞—Å—á–∞—Ä–∞–≤–∞–Ω–Ω–µ –ø–∞—Ü—ã–µ–Ω—Ç–∞—û[199]. –°—Ç—ã–º—É–ª—é—é—á—ã—è –º–µ—Ç–∞–¥—ã —Ç—ç—Ä–∞–ø—ñ—ñ —û–∫–ª—é—á–∞—é—Ü—å –∞—Ä—Ç-—Ç—ç—Ä–∞–ø—ñ—é, –º—É–∑—ã–∫–∞—Ç—ç—Ä–∞–ø—ñ—é, –∞ —Ç–∞–∫—Å–∞–º–∞ —Ä–∞–∑–Ω–∞–≤—ñ–¥–Ω–∞—Å—Ü—ñ —Ç—ç—Ä–∞–ø—ñ—ñ, –ø—Ä—ã —è–∫—ñ—Ö –ø–∞—Ü—ã–µ–Ω—Ç—ã –º–∞—é—Ü—å –∑–Ω–æ—Å—ñ–Ω—ã –∑ –∂—ã–≤—ë–ª–∞–º—ñ, –∑–∞–π–º–∞—é—Ü—Ü–∞ —Ñ—ñ–∑—ñ—á–Ω—ã–º—ñ –ø—Ä–∞–∫—Ç—ã–∫–∞–≤–∞–Ω–Ω—è–º—ñ —ñ –ª—é–±–æ–π —ñ–Ω—à–∞–π –∞–≥—É–ª—å–Ω–∞—û–∑–º–∞—Ü–Ω—è—é—á–∞–π –∞–∫—Ç—ã—û–Ω–∞—Å—Ü—é. –°—Ç—ã–º—É–ª—è—Ü—ã—è, –ø–∞ –¥–∞–¥–∑–µ–Ω—ã—Ö –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω—è—û, –≤–∞ —û–º–µ—Ä–∞–Ω–∞–π —Å—Ç—É–ø–µ–Ω—ñ —û–ø–ª—ã–≤–∞–µ –Ω–∞ –ø–∞–≤–æ–¥–∑—ñ–Ω—ã —ñ –Ω–∞—Å—Ç—Ä–æ–π —ñ —û –º–µ–Ω—à–∞–π —Å—Ç—É–ø–µ–Ω—ñ –Ω–∞ —û–∑—Ä–æ–≤–µ–Ω—å —Ñ—É–Ω–∫—Ü—ã—è–Ω–∞–≤–∞–Ω–Ω—è. –¢–∞–∫ —Ü—ñ —ñ–Ω–∞–∫—à, —Ç–∞–∫–∞—è —Ç—ç—Ä–∞–ø—ñ—è –ø—Ä–∞–≤–æ–¥–∑—ñ—Ü—Ü–∞ –ø–µ—Ä–∞–≤–∞–∂–Ω–∞ –¥–ª—è –ø–∞–ª—è–ø—à—ç–Ω–Ω—è —à—Ç–æ–¥–∑—ë–Ω–Ω–∞–≥–∞ –∂—ã—Ü—Ü—è –ø–∞—Ü—ã–µ–Ω—Ç–∞—û[199]. –ö–ª–æ–ø–∞—Ç —ñ –¥–æ–≥–ª—è–¥–ö–ª–æ–ø–∞—Ç —ñ –¥–æ–≥–ª—è–¥ –ø–∞—Ü—ã–µ–Ω—Ç–∞ –≤–µ–ª—å–º—ñ –≤–∞–∂–Ω—ã—è –ø—Ä–∞–∑ –Ω–µ–≤—ã–ª–µ—á–Ω–∞—Å—Ü—å —ñ –¥—ç–≥–µ–Ω–µ—Ä–∞—Ç—ã—û–Ω—ã —Ö–∞—Ä–∞–∫—Ç–∞—Ä —Ö–≤–∞—Ä–æ–±—ã. –Ý–æ–ª—é –¥–∞–≥–ª—è–¥—á—ã–∫–∞ —á–∞—Å—Ç–∞ –±—è—Ä—ç –Ω–∞ —Å—è–±–µ –º—É–∂ (–∞–±–æ –∂–æ–Ω–∫–∞) —Ü—ñ –±–ª—ñ–∑–∫—ñ —Å–≤–∞—è–∫[211]. –¢–∞–∫—ñ —Ü—è–∂–∞—Ä –º–æ—Ü–Ω–∞ –∞–¥–±—ñ–≤–∞–µ—Ü—Ü–∞ –Ω–∞ —Å–∞—Ü—ã—è–ª—å–Ω—ã–º, –ø—Å—ñ—Ö–∞–ª–∞–≥—ñ—á–Ω—ã–º, —ç–∫–∞–Ω–∞–º—ñ—á–Ω—ã–º —ñ —ñ–Ω—à—ã—Ö –±–∞–∫–∞—Ö –∂—ã—Ü—Ü—è —á–∞–ª–∞–≤–µ–∫–∞, —è–∫—ñ –¥–∞–≥–ª—è–¥–∞–µ —Ö–≤–æ—Ä–∞–≥–∞[212][213]. –ü–∞–∫–æ–ª—å–∫—ñ —Ö–≤–∞—Ä–æ–±–∞ –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ –Ω–µ–≤—ã–ª–µ—á–Ω–∞—è —ñ –ø–∞—Å—Ç—É–ø–æ–≤–∞ –ø—Ä—ã–≤–æ–¥–∑—ñ—Ü—å –¥–∞ —Å—Ç—Ä–∞—Ç—ã —á–∞–ª–∞–≤–µ–∫–∞–º –∑–¥–æ–ª—å–Ω–∞—Å—Ü–µ–π –∫–ª–∞–ø–∞—Ü—ñ—Ü—Ü–∞ –ø—Ä–∞ —Å—è–±–µ, –¥–æ–≥–ª—è–¥ —Ö–≤–æ—Ä–∞–≥–∞ —Ñ–∞–∫—Ç—ã—á–Ω–∞ —Å–∫–ª–∞–¥–∞–µ –∞—Å–Ω–æ–≤—É —Ç—ç—Ä–∞–ø—ñ—ñ —ñ –∑–∞—Å–ª—É–≥–æ—û–≤–∞–µ –∞—Å–∞–±–ª—ñ–≤–∞–π —É–≤–∞–≥—ñ –Ω–∞ —û—Å—ñ–º –ø—Ä–∞—Ü—è–≥—É —Ö–≤–∞—Ä–æ–±—ã. –ù–∞ —Ä–∞–Ω–Ω—è–π —ñ —û–º–µ—Ä–∞–Ω–∞–π —Å—Ç–∞–¥—ã—è—Ö —Ö–≤–∞—Ä–æ–±—ã –º–æ–∂–Ω–∞ –ø–∞–≤—ã—Å—ñ—Ü—å –±—è—Å–ø–µ–∫—É –ø–∞—Ü—ã–µ–Ω—Ç–∞ —ñ –ø–∞–ª–µ–≥—á—ã—Ü—å —Ü—è–∂–∫–∞—Å—Ü—å —è–≥–æ –¥–æ–≥–ª—è–¥—É, –∫–∞–ª—ñ —û–Ω–µ—Å—Ü—ñ –∑–º–µ–Ω—ã —û –Ω–∞–≤–∞–∫–æ–ª—å–Ω–∞–µ –∞—Å—è—Ä–æ–¥–¥–∑–µ —Ö–≤–æ—Ä–∞–≥–∞ —ñ —è–≥–æ –ª–∞–¥ –∂—ã—Ü—Ü—è[214][215]. –°—è—Ä–æ–¥ —Ç–∞–∫—ñ—Ö –º–µ—Ä ‚Äî –ø–µ—Ä–∞—Ö–æ–¥ –¥–∞ –ø—Ä–æ—Å—Ç–∞–≥–∞ —ñ —Ä—É—Ü—ñ–Ω–Ω–∞–≥–∞ —Ä–∞—Å–ø–∞—Ä–∞–¥–∫—É –¥–Ω—è, –Ω–∞—á—ç–ø–ª—ñ–≤–∞–Ω–Ω–µ –∞—Ö–æ—û–Ω—ã—Ö –∑–∞–º–∫–æ—û, —è—Ä–ª—ã–∫–æ—û –Ω–∞ —Ö–∞—Ç–Ω—ñ—è –ø—Ä—ã–ª–∞–¥—ã –∑ —Ç–ª—É–º–∞—á—ç–Ω–Ω–µ–º –ø–∞ —ñ—Ö –≤—ã–∫–∞—Ä—ã—Å—Ç–∞–Ω–Ω—ñ[199][216][217]. –ü–∞—Ü—ã–µ–Ω—Ç –º–æ–∂–∞ —Å—Ç—Ä–∞—Ü—ñ—Ü—å –∑–¥–æ–ª—å–Ω–∞—Å—Ü—å —Å–∞–º–∞—Å—Ç–æ–π–Ω–∞ —Ö–∞—Ä—á–∞–≤–∞—Ü—Ü–∞; —É —Ç–∞–∫—ñ–º –≤—ã–ø–∞–¥–∫—É —Ç—Ä—ç–±–∞ –¥—Ä–∞–±—ñ—Ü—å –µ–∂—É –∞–±–æ –ø–µ—Ä–∞–≤–æ–¥–∑—ñ—Ü—å —è–µ —û –∫–∞—à–∞–ø–∞–¥–æ–±–Ω—ã —Å—Ç–∞–Ω[218]. –ü—Ä—ã —û–∑–Ω—ñ–∫–Ω–µ–Ω–Ω—ñ –ø—Ä–∞–±–ª–µ–º –∑ –ø—Ä–∞–≥–ª—ã–Ω–∞–Ω–Ω–µ–º –µ–∂—ã –º–æ–∂–∞ —Å–ø–∞—Ç—Ä—ç–±—ñ—Ü—Ü–∞ —Ö–∞—Ä—á–∞–≤–∞–Ω–Ω–µ —Ö–≤–æ—Ä–∞–≥–∞ –ø—Ä–∞–∑ —Ç—Ä—É–±–∫—É. –£ —Ç–∞–∫—ñ–º –≤—ã–ø–∞–¥–∫—É –ø–µ—Ä–∞–¥ —á–ª–µ–Ω–∞–º—ñ —Å—è–º‚Äô—ñ —ñ –∞–±—Å–ª—É–≥–æ—û–≤–∞—é—á—ã–º –ø–µ—Ä—Å–∞–Ω–∞–ª–∞–º –ø–∞—û—Å—Ç–∞–µ —ç—Ç—ã—á–Ω–∞–µ –ø—ã—Ç–∞–Ω–Ω–µ –∞–± —Ç—ã–º, —è–∫ –¥–æ—û–≥–∞ –≤–∞—Ä—Ç–∞ –ø—Ä–∞—Ü—è–≥–≤–∞—Ü—å –∫–∞—Ä–º–ª–µ–Ω–Ω–µ, –Ω–∞–∫–æ–ª—å–∫—ñ –≥—ç—Ç–∞ —ç—Ñ–µ–∫—Ç—ã—û–Ω–∞ –∑ –º–µ–¥—ã—Ü—ã–Ω—Å–∫–∞–≥–∞ –ø—É–Ω–∫—Ç—É –≥–ª–µ–¥–∂–∞–Ω–Ω—è[219][220]. –ù–µ–∞–±—Ö–æ–¥–Ω–∞—Å—Ü—å —Ñ—ñ–∑—ñ—á–Ω–∞–π —Ñ—ñ–∫—Å–∞—Ü—ã—ñ –ø–∞—Ü—ã–µ–Ω—Ç–∞ —û–∑–Ω—ñ–∫–∞–µ —Ä—ç–¥–∫–∞, –∞–¥–Ω–∞–∫ —É –Ω–µ–∫–∞—Ç–æ—Ä—ã—Ö —Å—ñ—Ç—É–∞—Ü—ã—è—Ö —Å–≤–∞—è–∫—ñ –≤—ã–º—É—à–∞–Ω—ã—è –ø—Ä—ã–º–∞—Ü—å –º–µ—Ä—ã –ø–∞ —Ñ—ñ–∫—Å–∞—Ü—ã—ñ, –∫–∞–± –ø—Ä–∞–¥—É—Ö—ñ–ª—ñ—Ü—å —Ö–≤–æ—Ä–∞–≥–∞ –∞–¥ –Ω–∞–Ω—è—Å–µ–Ω–Ω—è –ø–∞—à–∫–æ–¥–∂–∞–Ω–Ω—è—û —Å–∞–±–µ –∞–±–æ –∞—Ç–∞—á—ç–Ω–Ω—é[199]. –ó —Ü—è–≥–∞–º —Ä–∞–∑–≤—ñ—Ü—Ü—è —Ö–≤–∞—Ä–æ–±—ã –º–æ–≥—É—Ü—å —É–∑–Ω—ñ–∫–∞—Ü—å —Ä–æ–∑–Ω—ã—è —û—Å–∫–ª–∞–¥–Ω–µ–Ω–Ω—ñ, –Ω–∞–ø—Ä—ã–∫–ª–∞–¥, –∑–∞—Ö–≤–æ—Ä–≤–∞–Ω–Ω—ñ –∑—É–±–æ—û —ñ –ø–∞—Ä–∞–∂–Ω—ñ–Ω—ã —Ä–æ—Ç–∞, –ø—Ä–æ–ª–µ–∂–Ω—ñ, –ø–∞—Ä—É—à—ç–Ω–Ω—ñ —Ö–∞—Ä—á–∞–≤–∞–Ω–Ω—è, –≥—ñ–≥—ñ–µ–Ω—ñ—á–Ω—ã—è –ø—Ä–∞–±–ª–µ–º—ã, —Ä—ç—Å–ø—ñ—Ä–∞—Ç–æ—Ä–Ω—ã—è, –≤–æ—á–Ω—ã—è –∞–±–æ —Å–∫—É—Ä–Ω—ã—è —ñ–Ω—Ñ–µ–∫—Ü—ã—ñ. –Ü—Ö –º–æ–∂–Ω–∞ –ø–∞–∑–±–µ–≥–Ω—É—Ü—å –ø—Ä—ã —Ä—É–ø–ª—ñ–≤—ã–º –¥–æ–≥–ª—è–¥–∑–µ, –∞–ª–µ –ø—Ä—ã —ñ—Ö —É–∑–Ω—ñ–∫–Ω–µ–Ω–Ω—ñ –Ω–µ–∞–±—Ö–æ–¥–Ω–∞–µ –ø—Ä–∞—Ñ–µ—Å—ñ–π–Ω–∞–µ —û–º—è—à–∞–Ω–Ω–µ[154][221][222][223][224][225]. –ü–∞–ª–µ–≥—á—ã—Ü—å –∞–¥—á—É–≤–∞–Ω–Ω–µ –ø–∞—Ü—ã–µ–Ω—Ç–∞ –ø–µ—Ä–∞–¥ –Ω–∞–¥—ã—Ö–æ–¥–∑—è—á–∞–π —Å–º–µ—Ä—Ü—é ‚Äî –∞—Å–Ω–æ—û–Ω–∞—è –∑–∞–¥–∞—á–∞ –Ω–∞ –∞–ø–æ—à–Ω—è–π —Å—Ç–∞–¥—ã—ñ —Ö–≤–∞—Ä–æ–±—ã[226]. –ü—Ä–∞–≥–Ω–æ–∑–ù–∞ —Ä–∞–Ω–Ω—ñ—Ö —Å—Ç–∞–¥—ã—è—Ö —Ö–≤–∞—Ä–æ–±–∞ –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ –±–ª–∞–≥–∞ –ø–∞–¥–¥–∞–µ—Ü—Ü–∞ –¥—ã—è–≥–Ω–æ—Å—Ç—ã—Ü—ã. –ü—ç—û–Ω—ã –¥—ã—è–≥–Ω–∞–∑ –∑–≤—ã—á–∞–π–Ω–∞ —Å—Ç–∞–≤—ñ—Ü—Ü–∞, –∫–∞–ª—ñ –∫–∞–≥–Ω—ñ—Ç—ã—û–Ω—ã—è –ø–∞—Ä—É—à—ç–Ω–Ω—ñ –ø–∞—á—ã–Ω–∞—é—Ü—å –∞–¥–±—ñ–≤–∞—Ü—Ü–∞ –Ω–∞ —à—Ç–æ–¥–∑—ë–Ω–Ω–∞–π –∞–∫—Ç—ã—û–Ω–∞—Å—Ü—ñ —á–∞–ª–∞–≤–µ–∫–∞, —Ö–∞—Ü—è —Å–∞–º —Ö–≤–æ—Ä—ã –º–æ–∂–∞ —è—à—á—ç –±—ã—Ü—å –∑–¥–æ–ª—å–Ω—ã–º –∂—ã—Ü—å –Ω–µ–∑–∞–ª–µ–∂–Ω—ã–º –∂—ã—Ü—Ü—ë–º. –ü–∞—Å—Ç—É–ø–æ–≤–∞ –ª—ë–≥–∫—ñ—è –ø—Ä–∞–±–ª–µ–º—ã —û –∫–∞–≥–Ω—ñ—Ç—ã—û–Ω–∞–π —Å—Ñ–µ—Ä—ã –∑–º—è–Ω—è—é—Ü—Ü–∞ –Ω–∞—Ä–∞—Å—Ç–∞—é—á—ã–º—ñ –∞–¥—Ö—ñ–ª–µ–Ω–Ω—è–º—ñ: —è–∫ –∫–∞–≥–Ω—ñ—Ç—ã—û–Ω—ã–º—ñ, –≥—ç—Ç–∞–∫ —ñ —ñ–Ω—à—ã–º—ñ, –ø—Ä—ã—á—ã–º –≥—ç—Ç—ã –ø—Ä–∞—Ü—ç—Å –Ω—è—û—Ö—ñ–ª—å–Ω–∞ –ø—Ä—ã–≤–æ–¥–∑—ñ—Ü—å —á–∞–ª–∞–≤–µ–∫–∞ —û —Å—Ç–∞–Ω –∑–∞–ª–µ–∂–Ω–∞—Å—Ü—ñ –∞–¥ —Å—Ç–∞—Ä–æ–Ω–Ω—è–π –¥–∞–ø–∞–º–æ–≥—ñ[133]. –ü—Ä–∞—Ü—è–≥–ª–∞—Å—Ü—å –∂—ã—Ü—Ü—è —û –≥—Ä—É–ø–µ —Ö–≤–æ—Ä—ã—Ö –∑–Ω—ñ–∂–∞–Ω–∞—è[10][227][228], –∞ –ø–∞—Å–ª—è –ø–∞—Å—Ç–∞–Ω–æ—û–∫—ñ –¥—ã—è–≥–Ω–∞–∑—É —è–Ω—ã –∂—ã–≤—É—Ü—å —É —Å—è—Ä—ç–¥–Ω—ñ–º –∫–∞–ª—è 7 –≥–∞–¥–æ—û[10]. –ú–µ–Ω—à –∑–∞ 3 % –ø–∞—Ü—ã–µ–Ω—Ç–∞—û –∑–∞—Å—Ç–∞—é—Ü—Ü–∞ –∂—ã–≤—ã–º—ñ –ø–∞—Å–ª—è 14 –≥–∞–¥–æ—û –∂—ã—Ü—Ü—è –∑ –¥—ã—è–≥–Ω–∞–∑–∞–º[11]. –ó –ø–∞–≤—ã—à–∞–Ω–∞–π —Å–º—è—Ä–æ—Ç–Ω–∞—Å—Ü—é –∞—Å–∞—Ü—ã—é—é—Ü—Ü–∞ —Ç–∞–∫—ñ—è –ø—Ä—ã–∫–º–µ—Ç—ã, —è–∫ –ø–∞–≤—ã—à–∞–Ω–∞—è —Ü—è–∂–∫–∞—Å—Ü—å –∫–∞–≥–Ω—ñ—Ç—ã—û–Ω—ã—Ö –ø–∞—Ä—É—à—ç–Ω–Ω—è—û, –∑–Ω—ñ–∂–∞–Ω—ã —û–∑—Ä–æ–≤–µ–Ω—å —Ñ—É–Ω–∫—Ü—ã—è–Ω–∞–≤–∞–Ω–Ω—è, –ø–∞–¥–∑–µ–Ω–Ω—ñ, –∞–¥—Ö—ñ–ª–µ–Ω–Ω—ñ –ø—Ä—ã –Ω–µ—û—Ä–∞–ª–∞–≥—ñ—á–Ω—ã–º –∞–≥–ª—è–¥–∑–µ. –Ü–Ω—à—ã—è —Å–ø–∞–¥–∞—Ä–æ–∂–Ω—ã—è –ø–∞—Ä—É—à—ç–Ω–Ω—ñ, –Ω–∞–ø—Ä—ã–∫–ª–∞–¥, –∫–∞—Ä–¥—ã—è–ª–∞–≥—ñ—á–Ω—ã—è –ø—Ä–∞–±–ª–µ–º—ã, –¥—ã—è–±–µ—Ç, –∞–ª–∫–∞–≥–∞–ª—ñ–∑–º —É –∞–Ω–∞–º–Ω–µ–∑–µ, —Ç–∞–∫—Å–∞–º–∞ –∑–≤—è–∑–∞–Ω—ã—è —Å–∞ –∑–Ω—ñ–∂–∞–Ω—ã–º –≤—ã–∂—ã–≤–∞–Ω–Ω–µ–º[227][229][230]. –ß—ã–º —Ä–∞–Ω–µ–π –ø–∞—á—ã–Ω–∞–µ—Ü—Ü–∞ —Ö–≤–∞—Ä–æ–±–∞ –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞, —Ç—ã–º –±–æ–ª–µ–π –≥–∞–¥–æ—û —É —Å—è—Ä—ç–¥–Ω—ñ–º –ø–∞—Ü—ã–µ–Ω—Ç –º–æ–∂–∞ –ø—Ä–∞–∂—ã—Ü—å –ø–∞—Å–ª—è –¥—ã—è–≥–Ω–∞–∑—É, –∞–ª–µ –ø—Ä—ã –ø–∞—Ä–∞—û–Ω–∞–Ω–Ω—ñ —Å–∞ –∑–¥–∞—Ä–æ–≤—ã–º—ñ –ª—é–¥–∑—å–º—ñ –∞–≥—É–ª—å–Ω–∞—è –ø—Ä–∞—Ü—è–≥–ª–∞—Å—Ü—å –∂—ã—Ü—Ü—è —Ç–∞–∫–æ–≥–∞ —á–∞–ª–∞–≤–µ–∫–∞ –∞—Å–∞–±–ª—ñ–≤–∞ –Ω—ñ–∑–∫–∞—è[228]. –ü—Ä–∞–≥–Ω–æ–∑ –ø–∞ –≤—ã–∂—ã–≤–∞–ª—å–Ω–∞—Å—Ü—ñ —û –∂–∞–Ω—á—ã–Ω –±–æ–ª—å—à —Å–ø—Ä—ã—è–ª—å–Ω—ã, —á—ã–º —É –º—É–∂—á—ã–Ω[11][231]. –°–º—è—Ä–æ—Ç–Ω–∞—Å—Ü—å —É –ø–∞—Ü—ã–µ–Ω—Ç–∞—û —É 70 % –≤—ã–ø–∞–¥–∫–∞—û –∞–±—É–º–æ—û–ª—ñ–≤–∞–µ—Ü—Ü–∞ —Å–∞–º–æ–π —Ö–≤–∞—Ä–æ–±–∞–π[10], –ø—Ä—ã –≥—ç—Ç—ã–º –Ω–∞–π—á–∞—Å—Ü–µ–π –Ω–µ–ø–∞—Å—Ä—ç–¥–Ω—ã–º—ñ –ø—Ä—ã—á—ã–Ω–∞–º—ñ —Å–º–µ—Ä—Ü—ñ –∑‚Äô—è—û–ª—è—é—Ü—Ü–∞ –ø–Ω–µ—û–º–∞–Ω—ñ—è —ñ –¥—ç–≥—ñ–¥—Ä–∞—Ç–∞—Ü—ã—è. –®—Ç–æ —Ü—ñ–∫–∞–≤–∞, —Ä–∞–∫ –ø—Ä—ã —Ö–≤–∞—Ä–æ–±–µ –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ —Å—É—Å—Ç—Ä–∞–∫–∞–µ—Ü—Ü–∞ —Ä–∞–¥–∑–µ–π, —á—ã–º —É –∞–≥—É–ª—å–Ω–∞–π –ø–∞–ø—É–ª—è—Ü—ã—ñ[10][231]. –ü—Ä–∞—Ñ—ñ–ª–∞–∫—Ç—ã–∫–∞ –ú—ñ–∂–Ω–∞—Ä–æ–¥–Ω—ã—è –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω—ñ, –ø–∞–∫–ª—ñ–∫–∞–Ω—ã—è –∞—Ü–∞–Ω—ñ—Ü—å, –Ω–∞–∫–æ–ª—å–∫—ñ —Ç–∞—è —Ü—ñ —ñ–Ω—à–∞—è –º–µ—Ä–∞ –∑–¥–æ–ª—å–Ω–∞—è –∑–∞–ø–∞–≤–æ–ª—ñ—Ü—å –∞–±–æ –ø—Ä–∞–¥—É—Ö—ñ–ª—ñ—Ü—å —Ä–∞–∑–≤—ñ—Ü—Ü—ë —Ö–≤–∞—Ä–æ–±—ã, –Ω—è—Ä—ç–¥–∫–∞ –¥–∞—é—Ü—å —Å—É–ø—è—Ä—ç—á–ª—ñ–≤—ã—è –≤—ã–Ω—ñ–∫—ñ. –ü–∞–∫—É–ª—å —à—Ç–æ —è—à—á—ç –Ω—è–º–∞ —Ü–≤—ë—Ä–¥—ã—Ö —Å–≤–µ–¥—á–∞–Ω–Ω—è—û –ø—Ä—ç–≤–µ–Ω—Ç—ã—û–Ω–∞–≥–∞ –¥–∑–µ—è–Ω–Ω—è –ª—é–±–æ–≥–∞ –∑ —Ç—ã—Ö —Ñ–∞–∫—Ç–∞—Ä–∞—û, —à—Ç–æ —Ä–∞–∑–≥–ª—è–¥–∞–ª—ñ—Å—è[232][233][234]. –Ý–∞–∑–∞–º –∑ —Ç—ã–º, —ç–ø—ñ–¥—ç–º—ñ—è–ª–∞–≥—ñ—á–Ω—ã—è –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω—ñ –¥–∞–∑–≤–∞–ª—è—é—Ü—å –º–µ—Ä–∫–∞–≤–∞—Ü—å, —à—Ç–æ –Ω–µ–∫–∞—Ç–æ—Ä—ã—è —Ñ–∞–∫—Ç–∞—Ä—ã –∑ –º–∞–≥—á—ã–º–∞—Å—Ü—é –∫–∞—Ä—ç–∫—Ü—ã—ñ ‚Äî –¥—ã–µ—Ç–∞, —Ä—ã–∑—ã–∫–∞ —Å–∞—Ä–¥—ç—á–Ω–∞-—Å–∞—Å—É–¥–∑—ñ—Å—Ç—ã—Ö –∑–∞—Ö–≤–æ—Ä–≤–∞–Ω–Ω—è—û, –ø—Ä—ã—ë–º –ª–µ–∫–∞—û, –∫–∞–≥–Ω—ñ—Ç—ã—û–Ω–∞—è –∞–∫—Ç—ã—û–Ω–∞—Å—Ü—å —ñ —ñ–Ω—à—ã—è ‚Äî –∞—Å–∞—Ü—ã—é—é—Ü—Ü–∞ –∑ —ñ–º–∞–≤–µ—Ä–Ω–∞—Å—Ü—é —Ä–∞–∑–≤—ñ—Ü—Ü—è —Ö–≤–∞—Ä–æ–±—ã. –ê–¥–Ω–∞–∫ —Ä—ç–∞–ª—å–Ω—ã—è –¥–æ–∫–∞–∑—ã —ñ—Ö –∑–¥–æ–ª—å–Ω–∞—Å—Ü—ñ –ø—Ä–∞–¥—É—Ö—ñ–ª—ñ—Ü—å —Ö–≤–∞—Ä–æ–±—É –º–æ–≥—É—Ü—å –±—ã—Ü—å –∞—Ç—Ä—ã–º–∞–Ω—ã—è —Ç–æ–ª—å–∫—ñ –ø–∞—Å–ª—è –¥–∞–¥–∞—Ç–∫–æ–≤–∞–≥–∞ –≤—ã–≤—É—á—ç–Ω–Ω—è, —É —è–∫–æ–µ –±—É–¥—É—Ü—å —É–≤–∞—Ö–æ–¥–∑—ñ—Ü—å –∫–ª—ñ–Ω—ñ—á–Ω—ã—è –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω—ñ[235]. –ö–∞–º–ø–∞–Ω–µ–Ω—Ç—ã –º—ñ–∂–∑–µ–º–Ω–∞–º–æ—Ä—Å–∫–∞–π –¥—ã–µ—Ç—ã, —É —Ç—ã–º –ª—ñ–∫—É —Å–∞–¥–∞–≤—ñ–Ω–∞ —ñ –≥–∞—Ä–æ–¥–Ω—ñ–Ω–∞, —Ö–ª–µ–±, –ø—à–∞–Ω—ñ—Ü–∞ —ñ —ñ–Ω—à—ã—è –∫—Ä—É–ø—è–Ω—ã—è –∫—É–ª—å—Ç—É—Ä—ã, –∞–ª—ñ—û–∫–∞–≤—ã –∞–ª–µ–π, —Ä—ã–±–∞ —ñ —á—ã—Ä–≤–æ–Ω–∞–µ –≤—ñ–Ω–æ, –º–∞–≥—á—ã–º–∞, –∑–¥–æ–ª—å–Ω—ã—è –ø–∞–∞—Å–æ–±–∫—É –∞–±–æ —Ä–∞–∑–∞–º –∑–Ω—ñ–∂–∞—Ü—å —Ä—ã–∑—ã–∫—É —ñ –∑–º—è–∫—á–∞—Ü—å —Ü—è—á—ç–Ω–Ω–µ —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞[236][237][238][239][240]. –ü—Ä—ã—ë–º –Ω–µ–∫–∞—Ç–æ—Ä—ã—Ö –≤—ñ—Ç–∞–º—ñ–Ω–∞—û, —É —Ç—ã–º –ª—ñ–∫—É B12, B3, C —ñ —Ñ–æ–ª—ñ–µ–≤–∞—è –∫—ñ—Å–ª–∞—Ç–∞, –ø–∞–¥—á–∞—Å –Ω–µ–∫–∞—Ç–æ—Ä—ã—Ö –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω—è—û –±—ã—û –∑–≤—è–∑–∞–Ω—ã –∑ –ø–∞–Ω—ñ–∂–∞–Ω–∞–π —Ä—ã–∑—ã–∫–∞–π —Ä–∞–∑–≤—ñ—Ü—Ü—è —Ö–≤–∞—Ä–æ–±—ã[241][242][243][244], –∞–¥–Ω–∞–∫ —ñ–Ω—à—ã—è –ø—Ä–∞—Ü—ã –¥–∞–∑–≤–∞–ª—è—é—Ü—å –º–µ—Ä–∫–∞–≤–∞—Ü—å –∞–± –∞–¥—Å—É—Ç–Ω–∞—Å—Ü—ñ –∑–Ω–∞—á–Ω–∞–≥–∞ —û–ø–ª—ã–≤—É –Ω–∞ –ø–∞—á–∞—Ç–∞–∫ —ñ —Ü—è—á—ç–Ω–Ω–µ —Ö–≤–∞—Ä–æ–±—ã —ñ –∞–± —ñ–º–∞–≤–µ—Ä–Ω–∞—Å—Ü—ñ –ø–∞–±–æ—á–Ω—ã—Ö —ç—Ñ–µ–∫—Ç–∞—û[245][246][247][248][249]. –ö—É—Ä–∫—É–º—ñ–Ω, —è–∫—ñ –∑–º—è—à—á–∞–µ—Ü—Ü–∞ —û —Ä–∞—Å–ø–∞—û—Å—é–¥–∂–∞–Ω–∞–π —Å–ø–µ—Ü—ã—ñ, –ø—Ä—ã –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω—ñ –Ω–∞ –º—ã—à–∞—Ö –ø–∞–∫–∞–∑–∞—û –Ω–µ–∫–∞—Ç–æ—Ä—É—é –∑–¥–æ–ª—å–Ω–∞—Å—Ü—å –ø—Ä–∞–¥—É—Ö—ñ–ª—è—Ü—å –ø—ç—û–Ω—ã—è –∑–º–µ–Ω—ã —û –º–æ–∑–≥—É[250][251]. –§–∞–∫—Ç–∞—Ä—ã —Ä—ã–∑—ã–∫—ñ —Å–∞—Ä–¥—ç—á–Ω–∞-—Å–∞—Å—É–¥–∑—ñ—Å—Ç—ã—Ö –∑–∞—Ö–≤–æ—Ä–≤–∞–Ω–Ω—è—û, —Ç–∞–∫—ñ—è —è–∫ –≤—ã—Å–æ–∫—ñ —û–∑—Ä–æ–≤–µ–Ω—å —Ö–∞–ª–µ—Å—Ç—ç—Ä—ã–Ω—É —ñ –≥—ñ–ø–µ—Ä—Ç—ç–Ω–∑—ñ—è, –¥—ã—è–±–µ—Ç, –∫—É—Ä—ç–Ω–Ω–µ, –∞—Å–∞—Ü—ã—è–≤–∞–Ω—ã—è –∑ –ø–∞–≤—ã—à–∞–Ω–∞–π —Ä—ã–∑—ã–∫–∞–π —ñ –±–æ–ª—å—à —Ü—è–∂–∫—ñ–º —Ü—è—á—ç–Ω–Ω–µ–º —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞[252][253], –∞–ª–µ —Å—Ä–æ–¥–∫—ñ, —è–∫—ñ—è –∑–Ω—ñ–∂–∞—é—Ü—å —Ö–∞–ª–µ—Å—Ç—ç—Ä—ã–Ω (—Å—Ç–∞—Ç—ã–Ω—ã), –Ω–µ –ø–∞–∫–∞–∑–∞–ª—ñ —ç—Ñ–µ–∫—Ç—ã—û–Ω–∞—Å—Ü—ñ —û —è–µ –ø—Ä–∞–¥—É—Ö—ñ–ª–µ–Ω–Ω—ñ –∞–±–æ –ø–∞–ª—è–ø—à—ç–Ω–Ω—ñ —Å—Ç–∞–Ω—É —Ö–≤–æ—Ä—ã—Ö[254][255]. –î–æ—û–≥–∞—á–∞—Å–æ–≤–∞–µ —û–∂—ã–≤–∞–Ω–Ω–µ –Ω–µ—Å—Ç—ç—Ä–æ—ñ–¥–Ω—ã—Ö –ø—Ä–æ—Ü—ñ–∑–∞–ø–∞–ª–µ–Ω—á—ã—Ö —Å—Ä–æ–¥–∫–∞—û –∞—Å–∞—Ü—ã—é–µ—Ü—Ü–∞ —Å–∞ –∑–Ω—ñ–∂–∞–Ω–∞–π —ñ–º–∞–≤–µ—Ä–Ω–∞—Å—Ü—é —Ä–∞–∑–≤—ñ—Ü—Ü—è —Ö–≤–∞—Ä–æ–±—ã —û –Ω–µ–∫–∞—Ç–æ—Ä—ã—Ö –ª—é–¥–∑–µ–π[256]. –Ü–Ω—à—ã—è –ª–µ–∫—ñ, –Ω–∞–ø—Ä—ã–∫–ª–∞–¥, –≥–∞—Ä–º–æ–Ω–∞–∑–∞–º—è—à—á–∞–ª—å–Ω–∞—è —Ç—ç—Ä–∞–ø—ñ—è —û –∂–∞–Ω—á—ã–Ω, –±–æ–ª—å—à –Ω–µ –ª—ñ—á–∞—Ü—Ü–∞ —ç—Ñ–µ–∫—Ç—ã—û–Ω—ã–º—ñ —û –ø—Ä–∞–¥—É—Ö—ñ–ª–µ–Ω–Ω—ñ –¥—ç–º–µ–Ω—Ü—ã—ñ[257][258]. –°—ñ—Å—Ç—ç–º–∞—Ç—ã—á–Ω—ã –∞–≥–ª—è–¥ –≥—ñ–Ω–∫–≥–∞ –±—ñ–ª–æ–±–∞, —è–∫—ñ –ø—Ä–∞–≤–æ–¥–∑—ñ—û—Å—è —û 2007 –≥., –¥–∞–∑–≤–∞–ª—è–µ –º–µ—Ä–∫–∞–≤–∞—Ü—å –∞–± –Ω–µ–ø–∞—Å–ª—è–¥–æ—û–Ω—ã–º —ñ –Ω–µ–ø–µ—Ä–∞–∫–∞–Ω–∞—û—á—ã–º —Ö–∞—Ä–∞–∫—Ç–∞—Ä—ã –ø—Ä–∞–¥—Å—Ç–∞—û–ª–µ–Ω—ã—Ö —Å–≤–µ–¥—á–∞–Ω–Ω—è—û —É–∑–¥–∑–µ—è–Ω–Ω—è –ø—Ä—ç–ø–∞—Ä–∞—Ç–∞ –Ω–∞ –∫–∞–≥–Ω—ñ—Ç—ã—û–Ω—ã—è –ø–∞—Ä—É—à—ç–Ω–Ω—ñ[259], –∞ —è—à—á—ç –∞–¥–Ω–æ –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω–µ —Å—Ü–≤—è—Ä–¥–∂–∞–µ –∞–± –∞–¥—Å—É—Ç–Ω–∞—Å—Ü—ñ –¥–∑–µ—è–Ω–Ω—è –Ω–∞ –∑–∞—Ö–≤–æ—Ä–≤–∞–µ–º–∞—Å—Ü—å[260]. –Ü–Ω—Ç—ç–ª–µ–∫—Ç—É–∞–ª—å–Ω—ã—è –∑–∞–Ω—è—Ç–∫—ñ, —Ç–∞–∫—ñ—è —è–∫ —á—ã—Ç–∞–Ω–Ω–µ, –Ω–∞—Å—Ç–æ–ª—å–Ω—ã—è –≥—É–ª—å–Ω—ñ, —Ä–∞–∑–≥–∞–¥–≤–∞–Ω–Ω–µ –∫—Ä–∞—Å–≤–æ—Ä–¥–∞—û, —ñ–≥—Ä–∞ –Ω–∞ –º—É–∑—ã–∫–∞–ª—å–Ω—ã—Ö —ñ–Ω—Å—Ç—Ä—É–º–µ–Ω—Ç–∞—Ö, —Ä—ç–≥—É–ª—è—Ä–Ω—ã—è —Å–∞—Ü—ã—è–ª—å–Ω—ã—è –∫–∞–Ω—Ç–∞–∫—Ç—ã (–≥—É—Ç–∞—Ä–∫—ñ), –º–∞–≥—á—ã–º–∞, –∑–¥–æ–ª—å–Ω—ã—è –∑–∞–ø–∞–≤–æ–ª—ñ—Ü—å –Ω–∞–¥—ã—Ö–æ–¥ —Ö–≤–∞—Ä–æ–±—ã –∞–±–æ –∑–º—è–∫—á—ã—Ü—å —è–µ —Ä–∞–∑–≤—ñ—Ü—Ü—ë[261][262]. –í–∞–ª–æ–¥–∞–Ω–Ω–µ –¥–∑–≤—é–º–∞ –º–æ–≤–∞–º—ñ –∞—Å–∞—Ü—ã—é–µ—Ü—Ü–∞ –∑ –±–æ–ª—å—à –ø–æ–∑–Ω—ñ–º –ø–∞—á–∞—Ç–∫–∞–º —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞[263]. –ù–µ–∫–∞—Ç–æ—Ä—ã—è –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω—ñ –¥–∞–∑–≤–∞–ª—è—é—Ü—å –º–µ—Ä–∫–∞–≤–∞—Ü—å –∞–± –ø–∞–≤—ã—à–∞–Ω–∞–π —Ä—ã–∑—ã—Ü—ã —Ä–∞–∑–≤—ñ—Ü—Ü—è —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ —û —Ç—ã—Ö –ª—é–¥–∑–µ–π, —á—ã—è –ø—Ä–∞—Ü–∞ –∑–≤—è–∑–∞–Ω–∞—è –∑ —É–ø–ª—ã–≤–∞–º –º–∞–≥–Ω—ñ—Ç–Ω—ã—Ö –ø–∞–ª—ë—û[264][265], —Ç—Ä–∞–ø–ª–µ–Ω–Ω–µ–º —É –∞—Ä–≥–∞–Ω—ñ–∑–º –º–µ—Ç–∞–ª–∞—û, –∞—Å–∞–±–ª—ñ–≤–∞ –∞–ª—é–º—ñ–Ω—ñ—é[266][267], –∞–±–æ –≤—ã–∫–∞—Ä—ã—Å—Ç–∞–Ω–Ω–µ–º —Ä–∞—Å—Ç–≤–∞—Ä–∞–ª—å–Ω—ñ–∫–∞—û[268]. –ù–µ–∫–∞—Ç–æ—Ä—ã—è –∑ –≥—ç—Ç—ã—Ö –ø—É–±–ª—ñ–∫–∞—Ü—ã–π –∫—Ä—ã—Ç—ã–∫–∞–≤–∞–ª—ñ—Å—è –∑–∞ –Ω—ñ–∑–∫—É—é —è–∫–∞—Å—Ü—å –ø—Ä–∞—Ü—ã[269], –¥–∞ —Ç–∞–≥–æ –∂ —É —ñ–Ω—à—ã—Ö –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω—è—Ö –Ω–µ –±—ã–ª–∞ –≤—ã—Å–≤–µ—Ç–ª–µ–Ω–∞ —Å—É–≤—è–∑—å —Ñ–∞–∫—Ç–∞—Ä–∞—û –Ω–∞–≤–∞–∫–æ–ª—å–Ω–∞–≥–∞ –∞—Å—è—Ä–æ–¥–¥–∑—è –∑ —Ä–∞–∑–≤—ñ—Ü—Ü—ë–º —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞[270][271][272][273]. –°–∞—Ü—ã—è–ª—å–Ω—ã—è —ñ –∫—É–ª—å—Ç—É—Ä–Ω—ã—è –∞—Å–ø–µ–∫—Ç—ã —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞–ù–∞–≥—Ä—É–∑–∫–∞ –Ω–∞ –≥—Ä–∞–º–∞–¥—Å—Ç–≤–∞–°—è—Ä–æ–¥ —Ö–≤–∞—Ä–æ–±, —è–∫—ñ—è –Ω–∞–∫–ª–∞–¥–∞—é—Ü—å –≤—è–ª—ñ–∫—É—é –Ω–∞–≥—Ä—É–∑–∫—É –Ω–∞ –≥—Ä–∞–º–∞–¥—Å—Ç–≤–∞ —û —Ä–∞–∑–≤—ñ—Ç—ã—Ö –∫—Ä–∞—ñ–Ω–∞—Ö, —Ö–≤–∞—Ä–æ–±–∞ –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ —ñ –¥—ç–º–µ–Ω—Ü—ã—è —Ä–∞–∑–∞–º –º–æ–≥—É—Ü—å –∑–∞–π–º–∞—Ü—å –∞–¥–Ω–æ –∑ –ø–µ—Ä—à—ã—Ö –º–µ—Å—Ü–∞—û[16][17]. –£ –∫—Ä–∞—ñ–Ω–∞—Ö —É —Å—Ç–∞–¥—ã—ñ —Ä–∞–∑–≤—ñ—Ü—Ü—è, —Ç–∞–∫—ñ—Ö —è–∫ –ê—Ä–≥–µ–Ω—Ü—ñ–Ω–∞[274], —ñ –Ω–æ–≤—ã—Ö —Ä–∞–∑–≤—ñ—Ç—ã—Ö –∫—Ä–∞—ñ–Ω–∞—Ö (–Ý—ç—Å–ø—É–±–ª—ñ–∫–∞ –ö–∞—Ä—ç—è)[275], –≥—Ä–∞–º–∞–¥—Å–∫—ñ—è –≤—ã–¥–∞—Ç–∫—ñ —Ç–∞–∫—Å–∞–º–∞ –≤—ã—Å–æ–∫—ñ—è —ñ –ø—Ä–∞—Ü—è–≥–≤–∞—é—Ü—å —Ä–∞—Å—Ü—ñ. –Ü–º–∞–≤–µ—Ä–Ω–∞, —è–Ω—ã –ø–∞–¥—ã–º—É—Ü—Ü–∞ —è—à—á—ç –≤—ã—à—ç–π –∑ —Ü—è–≥–∞–º —Å—Ç–∞—Ä—ç–Ω–Ω—è –≥—Ä–∞–º–∞–¥—Å—Ç–≤–∞ —ñ —Å—Ç–∞–Ω—É—Ü—å –≤–∞–∂–Ω–∞–π —Å–∞—Ü—ã—è–ª—å–Ω–∞–π –ø—Ä–∞–±–ª–µ–º–∞–π. –£ –ª—ñ–∫ –≤—ã–¥–∞—Ç–∫–∞—û —É–≤–∞—Ö–æ–¥–∑—è—Ü—å –ø—Ä–∞–º—ã—è –º–µ–¥—ã—Ü—ã–Ω—Å–∫—ñ—è (–Ω–∞–ø—Ä—ã–∫–ª–∞–¥, —É—Ç—Ä—ã–º–∞–Ω–Ω–µ –¥–∞–º–æ—û —Å–∞—Å—Ç–∞—Ä—ç–ª—ã—Ö) —ñ –ø—Ä–∞–º—ã—è –Ω–µ–º–µ–¥—ã—Ü—ã–Ω—Å–∫—ñ—è (—Ö–∞—Ç–Ω—ñ –¥–æ–≥–ª—è–¥ —Ö–≤–æ—Ä–∞–≥–∞), –∞ —Ç–∞–∫—Å–∞–º–∞ —û—Å–∫–æ—Å–Ω—ã—è (—Å—Ç—Ä–∞—Ç–∞ –≤—ã—Ç–≤–æ—Ä—á–∞–π –∑–¥–æ–ª—å–Ω–∞—Å—Ü—ñ —á–∞–ª–∞–≤–µ–∫–∞ ‚Äî —ñ —Ö–≤–æ—Ä–∞–≥–∞ —ñ –¥–∞–≥–ª—è–¥—á—ã–∫–∞)[17]. –ê—Ü—ç–Ω–∫—ñ —û –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω—è—Ö –∞–¥—Ä–æ–∑–Ω—ñ–≤–∞—é—Ü—Ü–∞, –∞–ª–µ —û —Ü—ç–ª—ã–º –ø–∞ —Å–≤–µ—Ü–µ –≤—ã–¥–∞—Ç–∫—ñ –Ω–∞ –¥—ç–º–µ–Ω—Ü—ã—é –º–æ–≥—É—Ü—å —Å–∫–ª–∞–¥–∞—Ü—å –∫–∞–ª—è 160 –º–ª—Ä–¥ –¥–æ–ª–∞—Ä–∞—û —à—Ç–æ–≥–æ–¥[276], –∞ —û –ó–®–ê ‚Äî –∫–∞–ª—è 100 –º–ª—Ä–¥ –¥–æ–ª–∞—Ä–∞—û[17]. –°–∞–º—ã—è –≤—è–ª—ñ–∫—ñ—è –≥—Ä–∞–º–∞–¥—Å–∫—ñ—è –≤—ã–¥–∞—Ç–∫—ñ —ñ–¥—É—Ü—å –Ω–∞ –∞–ø–ª–∞—Ç—É –¥–æ—û–≥–∞—á–∞—Å–æ–≤–∞–≥–∞ –ø—Ä–∞—Ñ–µ—Å—ñ–π–Ω–∞–≥–∞ –¥–æ–≥–ª—è–¥—É —Ö–≤–æ—Ä–∞–≥–∞, —É –ø—Ä—ã–≤–∞—Ç–Ω–∞—Å—Ü—ñ, —ñ–Ω—Å—Ç—ã—Ç—É—Ü—ã—è–Ω–∞–ª—ñ–∑–∞—Ü—ã—é ‚Äî –Ω–∞ –≥—ç—Ç–∞ –ø–∞—Ç—Ä–∞–±—É–µ—Ü—Ü–∞ –¥–∞ –¥–∑–≤—é—Ö —Ç—Ä–∞—Ü–µ–π –∞–¥ —É—Å—è–≥–æ –∞–±‚Äô—ë–º—É —Å—Ä–æ–¥–∫–∞—û[16]. –•–∞—Ç–Ω—ñ –¥–æ–≥–ª—è–¥ —Ç–∞–∫—Å–∞–º–∞ –∞–±—ã—Ö–æ–¥–∑—ñ—Ü—Ü–∞ –¥–æ—Ä–∞–≥–∞[16], –∞—Å–∞–±–ª—ñ–≤–∞ –ø—Ä—ã —û–ª—ñ–∫—É –Ω–µ—Ñ–∞—Ä–º–∞–ª—å–Ω—ã—Ö —Å—è–º–µ–π–Ω—ã—Ö –≤—ã–¥–∞—Ç–∫–∞—û, —É —Ç—ã–º –ª—ñ–∫—É —á–∞—Å—É, —è–∫—ñ –º–∞—Ä–Ω—É–µ—Ü—Ü–∞, —ñ —Å—Ç—Ä–∞—Ç—ã –∑–∞—Ä–∞–±–æ—Ç–Ω–∞–π –ø–ª–∞—Ç—ã[277]. –í—ã–¥–∞—Ç–∫—ñ —û–∑—Ä–∞—Å—Ç–∞—é—Ü—å –ø—Ä—ã —Ü—è–∂–∫–∞–π –¥—ç–º–µ–Ω—Ü—ã—ñ —ñ –ø–∞—Ä—É—à—ç–Ω–Ω—è—Ö –ø–∞–≤–æ–¥–∑—ñ–Ω[278] —É —Å—É–≤—è–∑—ñ –∑ –Ω–µ–∞–±—Ö–æ–¥–Ω–∞—Å—Ü—é –º–∞—Ä–Ω–∞–≤–∞—Ü—å –±–æ–ª–µ–π —á–∞—Å—É –Ω–∞ –¥–æ–≥–ª—è–¥ —Ö–≤–æ—Ä–∞–≥–∞[277]. –ê–¥–ø–∞–≤–µ–¥–Ω–∞, –ª—é–±–∞—è —Ç—ç—Ä–∞–ø—ñ—è, —è–∫–∞—è –∑–º–æ–∂–∞ –∑–∞–ø–∞–≤–æ–ª—ñ—Ü—å –∑–≥–∞—Å–∞–Ω–Ω–µ –∫–∞–≥–Ω—ñ—Ç—ã—û–Ω—ã—Ö –∑–¥–æ–ª—å–Ω–∞—Å—Ü–µ–π, –∞–¥—Å—É–Ω—É—Ü—å —ñ–Ω—Å—Ç—ã—Ç—É—Ü—ã—è–Ω–∞–ª—ñ–∑–∞—Ü—ã—é –∞–±–æ –∑–º–µ–Ω—à—ã—Ü—å –∫–æ–ª—å–∫–∞—Å—Ü—å –≥–∞–¥–∑—ñ–Ω –¥–æ–≥–ª—è–¥—É —Ö–≤–æ—Ä–∞–≥–∞, –±—É–¥–∑–µ –∫–∞—Ä—ã—Å–Ω–∞–π –∑ —ç–∫–∞–Ω–∞–º—ñ—á–Ω–∞–≥–∞ –±–æ–∫—É. –≠–∫–∞–Ω–∞–º—ñ—á–Ω–∞—è –∞—Ü—ç–Ω–∫–∞ –º–µ—Ç–æ–¥—ã–∫ —Ç—ç—Ä–∞–ø—ñ—ñ, —è–∫—ñ—è —ñ—Å–Ω—É—é—Ü—å, –¥–∞–∑–≤–∞–ª—è–µ –º–µ—Ä–∫–∞–≤–∞—Ü—å –ø—Ä–∞ —Å—Ç–∞–Ω–æ—û—á—ã—è –≤—ã–Ω—ñ–∫—ñ[17]. –î–æ–≥–ª—è–¥ —Ö–≤–æ—Ä–∞–≥–∞–ê—Å–Ω–æ—û–Ω—ã –∫–ª–æ–ø–∞—Ç –ø—Ä–∞ –ø–∞—Ü—ã–µ–Ω—Ç–∞ –∑–≤—ã—á–∞–π–Ω–∞ –±—è—Ä—ç –Ω–∞ —Å—è–±–µ –º—É–∂ (–∞–±–æ –∂–æ–Ω–∫–∞) —Ü—ñ —ñ–Ω—à—ã –±–ª—ñ–∑–∫—ñ —Å–≤–∞—è–∫[211], —Ç—ã–º —Å–∞–º—ã–º –∑–Ω–∞—á–Ω–∞ –∞–±—Ü—è–∂–∞—Ä–≤–∞—é—á—ã —Å—è–±–µ, –±–æ –¥–æ–≥–ª—è–¥ –ø–∞—Ç—Ä–∞–±—É–µ —Ñ—ñ–∑—ñ—á–Ω–∞–π –Ω–∞–≥—Ä—É–∑–∫—ñ, —Ñ—ñ–Ω–∞–Ω—Å–∞–≤—ã—Ö –≤—ã–¥–∞—Ç–∫–∞—û, –∞–¥–±—ñ–≤–∞–µ—Ü—Ü–∞ –Ω–∞ —Å–∞—Ü—ã—è–ª—å–Ω—ã–º –±–æ–∫—É –∂—ã—Ü—Ü—è —ñ –ø—Å—ñ—Ö–∞–ª–∞–≥—ñ—á–Ω–∞ –≤–µ–ª—å–º—ñ —Ü—è–∂–∫—ñ[212][213][279]. –Ü –ø–∞—Ü—ã–µ–Ω—Ç—ã, —ñ —Å–≤–∞—è–∫—ñ –∑–≤—ã—á–∞–π–Ω–∞ –∞–¥–¥–∞—é—Ü—å –ø–µ—Ä–∞–≤–∞–≥—É —Ö–∞—Ç–Ω—è–º—É –¥–æ–≥–ª—è–¥—É[280]. –ü—Ä—ã –≥—ç—Ç—ã–º –º–∞–≥—á—ã–º–∞ –∞–¥–∫–ª–∞—Å—Ü—ñ –∞–±–æ —û–≤–æ–≥—É–ª–µ –ø–∞–∑–±–µ–≥–Ω—É—Ü—å –Ω–µ–∞–±—Ö–æ–¥–Ω–∞—Å—Ü—ñ —û –±–æ–ª—å—à –ø—Ä–∞—Ñ–µ—Å—ñ–π–Ω—ã–º —ñ –¥–∞—Ä–∞–≥—ñ–º –¥–æ–≥–ª—è–¥–∑–µ[280][281], –∞–¥–Ω–∞–∫ –¥–∑–≤–µ —Ç—Ä—ç—Ü—ñ –∂—ã—Ö–∞—Ä–æ—û —É –¥–∞–º–∞—Ö —Å–∞—Å—Ç–∞—Ä—ç–ª—ã—Ö —É—Å—ë –∂–∞ —Ö–≤–∞—Ä—ç—é—Ü—å –Ω–∞ –¥—ç–º–µ–Ω—Ü—ã—é[199]. –°—è—Ä–æ–¥ –∞—Å–æ–±, —è–∫—ñ—è –¥–±–∞—é—Ü—å –ø—Ä–∞ –¥—ç–º–µ–Ω—Ç–Ω–∞–≥–∞ —Ö–≤–æ—Ä–∞–≥–∞, –∞–¥–∑–Ω–∞—á–∞–µ—Ü—Ü–∞ –≤—ã—Å–æ–∫—ñ —û–∑—Ä–æ–≤–µ–Ω—å —Å–∞–º–∞—Ç—ã—á–Ω—ã—Ö –∑–∞—Ö–≤–æ—Ä–≤–∞–Ω–Ω—è—û —ñ —Ä–∞–∑–ª–∞–¥–∞—û –ø—Å—ñ—Ö—ñ–∫—ñ[282]. –ö–∞–ª—ñ —è–Ω—ã –∂—ã–≤—É—Ü—å –ø–∞–¥ –∞–¥–Ω—ã–º –¥–∞—Ö–∞–º –∑ —Ö–≤–æ—Ä—ã–º, –∫–∞–ª—ñ —Ö–≤–æ—Ä—ã ‚Äî –º—É–∂ —Ü—ñ –∂–æ–Ω–∫–∞, –∫–∞–ª—ñ —Ö–≤–æ—Ä—ã —û–ø–∞–¥–∞–µ —û –¥—ç–ø—Ä—ç—Å—ñ—é, –ø–∞–≤–æ–¥–∑—ñ—Ü—å —Å—è–±–µ –Ω–µ–∞–¥—ç–∫–≤–∞—Ç–Ω–∞, –≥–∞–ª—é—Ü—ã–Ω—ñ—Ä—É–µ, –ø–∞–∫—É—Ç—É–µ –∞–¥ –ø–∞—Ä—É—à—ç–Ω–Ω—è—û —Å–Ω—É —ñ –Ω–µ —û —Å—Ç–∞–Ω–µ –Ω–∞—Ä–º–∞–ª—å–Ω–∞ –ø–µ—Ä–∞—Å–æ—û–≤–∞—Ü—Ü–∞ ‚Äî —É—Å–µ –≥—ç—Ç—ã—è —Ñ–∞–∫—Ç–∞—Ä—ã, –ø–∞ –¥–∞–¥–∑–µ–Ω—ã—Ö –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω—è—û, –∑–≤—è–∑–∞–Ω—ã—è –∑ –ø–∞–≤—ã—à–∞–Ω–∞–π –∫–æ–ª—å–∫–∞—Å—Ü—é –ø—Å—ñ—Ö–∞—Å–∞—Ü—ã—è–ª—å–Ω—ã—Ö –ø—Ä–∞–±–ª–µ–º[283][284]. –î–±–∞—é—á—ã –ø—Ä–∞ —Ö–≤–æ—Ä–∞–≥–∞ —Ç–∞–∫—Å–∞–º–∞ –≤—ã–º—É—à–∞–Ω—ã –ø—Ä–∞–≤–æ–¥–∑—ñ—Ü—å –∑ —ñ–º —É —Å—è—Ä—ç–¥–Ω—ñ–º 47 –≥–∞–¥–∑—ñ–Ω –∑–∞ —Ç—ã–¥–∑–µ–Ω—å, —á–∞—Å—Ç–∞ –∞—Ö–≤—è—Ä—É—é—á—ã –ø—Ä–∞—Ü–æ—û–Ω—ã–º —á–∞—Å–∞–º, –ø—Ä—ã –≥—ç—Ç—ã–º –≤—ã–¥–∞—Ç–∫—ñ –Ω–∞ –¥–æ–≥–ª—è–¥ –≤—è–ª—ñ–∫—ñ—è. –ü—Ä–∞–º—ã—è —ñ —û—Å–∫–æ—Å–Ω—ã—è –≤—ã–¥–∞—Ç–∫—ñ –ø–∞ –¥–æ–≥–ª—è–¥–∑–µ –ø–∞—Ü—ã–µ–Ω—Ç–∞ —û –ó–®–ê —Å–∫–ª–∞–¥–∞—é—Ü—å —É —Å—è—Ä—ç–¥–Ω—ñ–º –∞–¥ 18 000 –¥–æ–ª–∞—Ä–∞—û –¥–∞ 77 500 –¥–æ–ª–∞—Ä–∞—û –∑–∞ –≥–æ–¥ –ø–∞ –¥–∞–¥–∑–µ–Ω—ã—Ö —Ä–æ–∑–Ω—ã—Ö –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω—è—û[283][284]. –ü–∞ –¥–∞–¥–∑–µ–Ω—ã—Ö –¥–∞—Å–ª–µ–¥–∞–≤–∞–Ω–Ω—è—û, –ø—Å—ñ—Ö–∞–ª–∞–≥—ñ—á–Ω–∞–µ –∑–¥–∞—Ä–æ—û–µ –∞—Å–æ–±, —è–∫—ñ—è –¥–±–∞—é—Ü—å –ø—Ä–∞ —Ö–≤–æ—Ä—ã—Ö, –º–æ–∂–Ω–∞ —û–∑–º–∞—Ü–Ω—ñ—Ü—å –º–µ—Ç–∞–¥–∞–º—ñ –∫–∞–≥–Ω—ñ—Ç—ã—û–Ω–∞–π –ø–∞–≤–æ–¥–∑—ñ–Ω–Ω–∞–π —Ç—ç—Ä–∞–ø—ñ—ñ —ñ –Ω–∞–≤—É—á–∞–Ω–Ω–µ–º —Å—Ç—Ä–∞—Ç—ç–≥—ñ—è–º –ø—Ä–æ—Ü—ñ–¥–∑–µ—è–Ω–Ω—è —Å—Ç—Ä—ç—Å—É —è–∫ —ñ–Ω–¥—ã–≤—ñ–¥—É–∞–ª—å–Ω–∞, –≥—ç—Ç–∞–∫ —ñ —û –≥—Ä—É–ø–∞—Ö[212][285]. –•–≤–∞—Ä–æ–±–∞ –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ —û –∫—ñ–Ω–µ–º–∞—Ç–æ–≥—Ä–∞—Ñ–µ –•–≤–∞—Ä–æ–±–∞ –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ –∞–¥–ª—é—Å—Ç—Ä–æ—û–≤–∞–µ—Ü—Ü–∞ —û —Ç–∞–∫—ñ—Ö —Ñ—ñ–ª—å–º–∞—Ö, —è–∫ ¬´–ê–π—Ä—ã—Ŭª[286] (—Å—é–∂—ç—Ç –≥—Ä—É–Ω—Ç—É–µ—Ü—Ü–∞ –Ω–∞ –º–µ–º—É–∞—Ä–∞—Ö –î–∂–æ–Ω–∞ –ë—ç–π–ª—ñ ‚Äî –º—É–∂–∞ –ê–π—Ä—ã—Å –ú—ë—Ä–¥–∞–∫[287]), ¬´–î–∑—ë–Ω–Ω—ñ–∫ –ø–∞–º—è—Ü—ñ¬ª[288] (–ø–∞ –∞–¥–Ω–∞–π–º–µ–Ω–Ω—ã–º —Ä–∞–º–∞–Ω–µ –ù—ñ–∫–∞–ª–∞—Å–∞ –°–ø–∞—Ä–∫—Å–∞[289]), ¬´–ù–µ —Ö–∞—á—É –∑–∞–±—ã–≤–∞—ܗ嬪 (–∞–±–æ ¬´–°—Ü—ñ—Ä–∫–∞ —û –º–∞—ë–π –≥–∞–ª–∞–≤–µ¬ª)[290], ¬´–¢–∞–Ω–º–∞—Ç—Ä–∞¬ª[291], ¬´–ü–∞–º—è—Ü—å –∞–± –∑–∞—û—Ç—Ä–∞—à–Ω—ñ–º –¥–Ω—ñ¬ª[292], ¬´–î–∞–ª—ë–∫–∞ –∞–¥ —è–µ¬ª (–ø–∞ –∞–ø–∞–≤—è–¥–∞–Ω–Ω—ñ –≠–ª—ñ—Å –ú–∞–Ω—Ä–æ ¬´–ú—è–¥–∑–≤–µ–¥–∑—å –ø–µ—Ä–∞–π—à–æ—û –ø—Ä–∞–∑ –≥–∞—ėɬª[293]), ¬´–ü–∞—û—Å—Ç–∞–Ω–Ω–µ –ø–ª–∞–Ω–µ—Ç—ã –º–∞–ª–ø–∞—û¬ª, ¬´–°–µ–∫—Å –ø–∞ –¥—Ä—É–∂–±–µ¬ª, ¬´–õ—é–±–æ—û —ñ —ñ–Ω—à—ã—è –ª–µ–∫—ñ¬ª, ¬´–ñ–∞–ª–µ–∑–Ω–∞—è –ª—ç–¥–∑—ñ¬ª, ¬´–Ý–∞–∑–≤–æ–¥ –ù–∞–¥–∑–µ—Ä–∞ —ñ –°—ñ–º—ñ–Ω¬ª, ¬´–ì–ª—ã–±–æ–∫–∞–µ —Å—ñ–Ω—è–µ –º–æ—Ä–∞¬ª —ñ ¬´–£—Å—ë —è—à—á—ç –≠–ª—ñ—Ŭª; —É —Å–µ—Ä—ã—è–ª–∞—Ö ¬´–ß–æ—Ä–Ω–∞—è –ª–∞–≥—É–Ω–∞¬ª (7 —Å–µ–∑–æ–Ω), ¬´–°—Ç–æ–ª—ñ–∫ —É –∫—É—Ü–µ¬ª, ¬´–ê–Ω–∞—Ç–æ–º—ñ—è –∂–∞–¥–∞–Ω–Ω—è¬ª (–∞–±–æ ¬´–ê–Ω–∞—Ç–æ–º—ñ—è –ì—Ä—ç–π¬ª), ¬´–¢—ç–æ—Ä—ã—è –º–∞–Ω—ã¬ª (3 —Å–µ–∑–æ–Ω, 7 —Å–µ—Ä—ã—è), ¬´–î—ç—Ç—ç–∫—Ç—ã—û –ù—ç—à –ë—Ä—ã–¥–∂—ç—Ŭª. –°—è—Ä–æ–¥ –¥–∞–∫—É–º–µ–Ω—Ç–∞–ª—å–Ω—ã—Ö —Ñ—ñ–ª—å–º–∞—û –º–æ–∂–Ω–∞ –≤—ã–ª—É—á—ã—Ü—å —Ç–∞–∫—ñ—è –ø—Ä–∞—Ü—ã, —è–∫ ¬´–ú–∞–ª–∫–æ–ª—å–º —ñ –ë–∞—Ä–±–∞—Ä–∞: –≥—ñ—Å—Ç–æ—Ä—ã—è –∫–∞—Ö–∞–Ω–Ω—è¬ª —ñ ¬´–ú–∞–ª–∫–æ–ª—å–º —ñ –ë–∞—Ä–±–∞—Ä–∞: —Ä–∞–∑–≤—ñ—Ç–∞–Ω–Ω–µ –∫–∞—Ö–∞–Ω–Ω—è¬ª –∑ —É–¥–∑–µ–ª–∞–º –ú–∞–ª–∫–æ–ª—å–º–∞ –ü—É–∞–Ω—Ç–æ–Ω–∞[294][295][296]. –í—è–¥–æ–º—ã—è –ª—é–¥–∑—ñ, —è–∫—ñ—è —Å—Ç–∞–ª—ñ –∞—Ö–≤—è—Ä–∞–º—ñ —Ö–≤–∞—Ä–æ–±—ã –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞–ù–∞ —Ö–≤–∞—Ä–æ–±—É –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞ —Ö–≤–∞—Ä—ç–ª—ñ —ñ —Ö–≤–∞—Ä—ç—é—Ü—å –º–Ω–æ–≥—ñ—è –ª—é–¥–∑—ñ, —É —Ç—ã–º –ª—ñ–∫—É —Ç–∞–∫—ñ—è –≤—è–¥–æ–º—ã—è, —è–∫ –±—ã–ª—ã –ø—Ä—ç–∑—ñ–¥—ç–Ω—Ç –ó–®–ê –Ý–æ–Ω–∞–ª—å–¥ –Ý—ç–π–≥–∞–Ω —ñ —ñ—Ä–ª–∞–Ω–¥—Å–∫–∞—è –ø—ñ—Å—å–º–µ–Ω–Ω—ñ—Ü–∞ –ê–π—Ä—ã—Å –ú—ë—Ä–¥–∞–∫. –§–∞–∫—Ç —Ö–≤–∞—Ä–æ–±—ã –∞–±–æ–¥–≤—É—Ö –Ω–µ —Ç–æ–ª—å–∫—ñ —à—ã—Ä–æ–∫–∞ –∞—Å–≤—è—Ç–ª—è—û—Å—è —û –°–ú–Ü, –∞–ª–µ —ñ —Å—Ç–∞—û –ø–∞–¥—Å—Ç–∞–≤–∞–π –¥–ª—è –Ω–∞–≤—É–∫–æ–≤—ã—Ö –∞—Ä—Ç—ã–∫—É–ª–∞—û, –∞—û—Ç–∞—Ä—ã —è–∫—ñ—Ö –∞–Ω–∞–ª—ñ–∑—É—é—Ü—å –ø—Ä–∞–≥—Ä—ç—Å—ñ—Ä—É—é—á–∞–µ –∞—Å–ª–∞–±–ª–µ–Ω–Ω–µ –∫–∞–≥–Ω—ñ—Ç—ã—û–Ω—ã—Ö —Ñ—É–Ω–∫—Ü—ã–π –¥–∞–¥–∑–µ–Ω—ã—Ö –ø—É–±–ª—ñ—á–Ω—ã—Ö –ø–µ—Ä—Å–æ–Ω[297][298]. –Ü–Ω—à—ã–º—ñ –∑–Ω–∞–∫–∞–º—ñ—Ç—ã–º—ñ –∞—Ö–≤—è—Ä–∞–º—ñ —Ö–≤–∞—Ä–æ–±—ã —Å—Ç–∞–ª—ñ —Ñ—É—Ç–±–∞–ª—ñ—Å—Ç –§–µ—Ä—ç–Ω—Ü –ü—É—à–∫–∞—à[299], –±—ã–ª—ã—è –ø—Ä—ç–º'–µ—Ä-–º—ñ–Ω—ñ—Å—Ç—Ä—ã –í—è–ª—ñ–∫–∞–±—Ä—ã—Ç–∞–Ω—ñ—ñ –ì–∞—Ä–∞–ª—å–¥ –í—ñ–ª—å—Å–∞–Ω —ñ –ú–∞—Ä–≥–∞—Ä—ç—Ç –¢—ç—Ç—á—ç—Ä[300], –ø—Ä—ç–º‚Äô–µ—Ä-–º—ñ–Ω—ñ—Å—Ç—Ä –Ü—Å–ø–∞–Ω—ñ—ñ –ê–¥–æ–ª—å—Ñ–∞ –°—É–∞—Ä—ç—Å[301][302], –∞–∫—Ü—ë—Ä—ã –ü—ñ—Ç—ç—Ä –§–∞–ª—å–∫[303], –Ý—ã—Ç–∞ –•–µ–π–≤–∞—Ä—Ç[304], –ê–Ω–Ω—ñ –ñ—ã—Ä–∞—Ä–¥–æ —ñ –ß–∞—Ä–ª—Ç–∞–Ω –•–µ—Å—Ç–∞–Ω[305], –ø—ñ—Å—å–º–µ–Ω–Ω—ñ–∫ –¢—ç—Ä—ã –ü—Ä–∞—Ç—á—ç—Ç[306]. –ö—Ä—ã–Ω—ñ—Ü—ã
–õ—ñ—Ç–∞—Ä–∞—Ç—É—Ä–∞–ù–∞ —Ä—É—Å–∫–∞–π –º–æ–≤–µ:
–ù–∞ –∞–Ω–≥–ª—ñ–π—Å–∫–∞–π –º–æ–≤–µ:
–°–ø–∞—Å—ã–ª–∫—ñ
|
||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia














