சோடியம் தெலூரைட்டு
சோடியம் தெலூரைட்டு (Sodium tellurite) என்பது Na2TeO3 என்ற மூலக்கூற்று வாய்ப்பாட்டால் விவரிக்கப்படும் கனிம வேதியியல் சேர்மமாகும். தண்ணீரில் கரையும். வலிமை குறைந்த ஒரு குறைக்கும் முகவர் ஆகும். சோடியம் தெலூரைட்டு என்பது தெலூரியம் என்ற தனிமத்தை பிரித்தெடுக்கும் போது ஓர் இடைநிலைப் பொருளாகும். எதிர்மின்வாய் கசடுகளிலிருந்து பெறப்படும் இச்சேர்மம் தெலூரியத்திற்கு ஒரு முன்னோடிச் சேர்மமுமாகும். தயாரிப்புதெலூரியத்தின் முக்கிய ஆதாரம் தாமிர எதிர்மின் முனைகளில் கிடைக்கும் கசடுகளிலிருந்து கிடைக்கிறது. இக்கசடில் விலைமதிப்பற்ற உலோகங்கள் மற்றும் பல்வேறு தெலூரைடுகள் இருக்கும். இதை சோடியம் கார்பனேட்டு மற்றும் ஆக்சிசனுடன் சேர்த்து வறுத்து சோடியம் தெலூரைட்டு உருவாக்கப்படுகிறது.[1]
இவ்வினை வெள்ளி தெலூரைடின் ஒரு வினையாகும். தெலூரைடு சேர்மம் ஆக்சிசனேற்றப்பட்டு தெலூரைட்டாக மாற்றப்படுகிறது. வெள்ளி(I) சேர்மம் வெள்ளியாகக் குறைக்கப்படுகிறது. தூய்மையாக்கல்ஒரு தெலூரைட்டு கரைசலின் மின்னாற்பகுப்பு வினை சுத்திகரிக்கப்பட்ட தெலூரியத்தை அளிக்கிறது.[1]
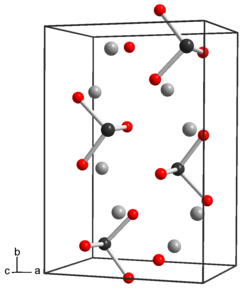
கட்டமைப்பும் பண்புகளும்தெலூரியம் தனிமம் கந்தகம் மற்றும் செலீனியம் போன்ற தனிமங்களின் பண்புகளைக் கொண்டுள்ளது. நீரற்ற வடிவமான Na2TeO3 சேர்மத்தில் தெலூரியம் அணுக்கள் 6 ஒருங்கிணைப்புகளையும் 1.87 Å தொலைவில் மூன்று Te-O ஆகவும், 2.9 Å தொலைவில் மூன்று Te-O ஆகவும் அமைந்து சிதைந்த எண்முகி பகிர்வு விளிம்புகளைக் கொண்டதாகவும் உள்ளன.[2] ஐந்துநீரேற்றில் (Na2TeO3.5H2O) பிரமிடு வடிவிலான TeO32− என்ற தனித்தனி தெலூரைட்டு எதிர்மின் அயனிகள் உள்ளன. Te-O பிணைப்பின் தூரம் 1.85 - 1.86 Å ஆகவும் O-Te-O பிணைப்புக் கோணம் 99.5 பாகைக்கு அருகிலும் உள்ளது.[3] தெலூரைட்டு எதிர்மின் அயனி ஒரு பலவீனமான காரமாகும். சோடியம் தெலூரைட்டு சேர்மமானது சோடியம் செலீனைட்டு மற்றும் சோடியம் சல்பைட்டு சேர்மங்களை ஒத்திருக்கிறது. மேலும், சோடியம் தெலூரைட்டு ஒரு பலவீனமான ஆக்சிசனேற்ற முகவர் ஆகவும் பலவீனமான குறைக்கும் முகவர் ஆகவும் செயல்படுகிறது. தெலூரைட்டு தொடர்பான வினைகள்
இந்த pKa அளவில் தெலூரிக்கு அமிலம் ஒரு புரோட்டானை இழக்கிறது.
இந்த pKa-அளவில் ஐதரசன் தெலூரைட்டு ஒரு புரோட்டானை இழந்து தெலூரைட்டு அயனியாக மாறுகிறது. இது தெலூரசு அமிலமும் சோடியம் ஐதராக்சைடும் வினைபுரிந்து சோடியம் தெலூரைட்டை உருவாக்கும் போது நிகழும்.
இவ்வினை தெலூரியம் டை ஆக்சைடு ஒரு காரத்துடன் சேர்ந்து வினைபுரிந்து தெலூரைட்டு உப்பை உருவாக்கும் ஒரு வினையாகும். பயன்பாடுகள்மின்முலாம் பூசப்பட்ட நிக்கல் அடுக்குகளின் அரிப்பு எதிர்ப்பை சோடியம் தெலூரைட்டு மேம்படுத்துகிறது. இரும்பு, எஃகு, அலுமினியம் மற்றும் தாமிரம் ஆகியவற்றின் மீது கருப்பு அல்லது நீல-கருப்பு பூச்சுகளுக்கு சோடியம் தெலூரைட்டின் கரைசல்கள் பயன்படுத்தப்படுகின்றன. நுண்ணுயிரியலில், சோடியம் தெலூரைட்டை வளர்ச்சி ஊடகத்தில் சேர்க்கலாம். இதன் நச்சுத்தன்மைக்கு உள்ளார்ந்த உடலியல் எதிர்ப்புத் திறன் கொண்ட பாக்டீரியாக்களையும் தனிமைப்படுத்தலாம்.[4] மேற்கோள்கள்
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia