பேரியம் குளோரைடு
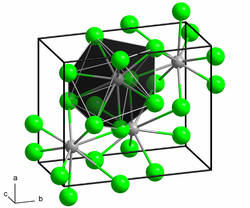
பேரியம் குளோரைடு (Barium Chloride) BaCl2 என்ற மூலக்கூறு வாய்ப்பாட்டை உடைய ஒரு கனிமச் சேர்மம் ஆகும். இது ஒரு மிகவும் பொதுவான நீரில் கரையக்கூடிய பேரியத்தின் உப்பாகும். மற்ற பேரியம் உப்புக்களைப் போல, இதுவும் நச்சுத்தன்மை வாய்ந்ததாகும். எரியும் போது மஞ்சள் கலந்த பச்சை நிறத்தைச் சுடருக்குத் தருகிறது. இது நீர் உறிஞ்சும் தன்மை கொண்டதாகும். அமைப்பு மற்றும் பண்புகள்BaCl2 இரண்டு வடிவங்களில் படிகமாகிறது(பல் உருவ அமைப்புகள்). ஒரு வடிவமானது, கன சதுர படிக புளோரைட்டு (CaF2) வடிவ அமைப்பைக் கொண்டுள்ளது. மற்றொன்று செஞ்சாய்சதுர படிக வடிவ கோட்டுனைட்டு (PbCl2) வடிவம் ஆகும். இரண்டு பல் உருவஅமைப்புகளுமே பெரிய Ba2+ அயனிக்கு, ஆறை விடப்பெரிய அணைவு எண்ணையே தருகின்றன.[5] புளோரைட்டு வடிவத்தில் Ba2+ அயனியின் அணைவு எண் 8 ஆகவும் [6] கோட்டுனைட் (காரீய (II) குளோரைடு என்ற கனிமத்தின் வடிவத்தையொத்த) என்ற வடிவத்தில் அணைவு எண் 9 ஆகவும் காணப்படுகிறது.[7] BaCl2 இன் கோட்டுனைட்டு வடிவத்தின் மீது 7–10 கிகாபாசுகல் அளவிற்கு அழுத்தத்திற்குட்படுத்தும் போது அது இன்னொரு மூன்றாவது வடிவத்திற்கு ஒற்றைச்சாய்வு படிக வடிவத்திற்கு (கோட்டுனைட்டின் தொடர் நிலை) மாறுகிறது. இந்த வடிவத்தில் Ba2+ இன் அணைவு எண்ணானது 9 இலிருந்து 10 ஆக உயர்கிறது.[8] நீரிய கரைசல்களில் BaCl2 ஒரு எளிய உப்பைப் போலவே இருக்கிறது. நீரில் இது ஒரு 1:2 மின்பகுளியாகவும் இதன் கரைசலானது நடுநிலையான காரகாடித்தன்மைச் சுட்டெண் மதிப்பையும் கொண்டுள்ளது. இதன் கரைசல் சல்பேட்டு அயனியுடன் வினைபடும் போது ஒரு அடர் வெண்மையான பேரியம் சல்பேட்டு வீழ்படிவைத் தருகிறது:
ஆக்சலேட்டும் இதே போன்றதொரு வினையைத் தருகிறது:
இது சோடியம் ஐதராக்சைடுடன் வினைபுரியும் போது மிதமான அளவில் நீரில் கரையக்கூடிய டைஐதராக்சைடைத் தருகிறது. தயாரிப்புபேரியம் குளோரைடானது பேரியம் ஐதராக்சைடு அல்லது இயற்கையில் கிடைக்கக்கூடிய கனிமமான விதரைட்டுடன் சேர்ந்த பேரியம் கார்பனேட்டிலிருந்து தயாரிக்கப்படுகிறது. இந்த எளிய அடிப்படை உப்புக்கள் ஐதரோகுளோரிக் அமிலத்துடன் வினைபுரிந்து நீரேற்றப்பட்ட பேரியம் குளோரைடினைத் தருகிறது. தொழில்முறை தயாரிப்பில் பேரைட்டிலிருந்து (பேரியம் சல்பேட்டு) பெறப்படக்கூடிய இரண்டு படிநிலைகளைக் கொண்ட செயல்முறையானது பயன்படுத்தப்படுகிறது:[9]
இந்த முதல் படிநிலையானது நிகழ்வதற்கு அதிக வெப்பநிலை தேவைப்படுகிறது. இரண்டாவது படிநிலையில், வினைபடுபொருட்களின் உருகுதல் நிகழ்த்தப்பட வேண்டியுள்ளது. BaCl2 ஆனது நீருடனான கலவையிலிருந்து வடித்தெடுக்கப்படலாம். பேரியம் குளோரைடின் நீரிய கரைசல்களிலிருந்து, டைஐதரேட்டானது வெண்ணிறப்படிகங்களாக படிகமாக்கப்படலாம்: BaCl2•2H2O பயன்கள்விலைமலிவான பேரியத்தின் கரையக்கூடிய உப்பாக இருப்பதால், பேரியம் குளோரைடு ஆய்வகத்தில் மிக விரிவான பயன்பாட்டைக் கொண்டுள்ளது. இது சல்பேட்டு அயனிக்கான பண்பறி பகுப்பாய்வில் மிக முக்கியமான சோதனையாக உள்ளது. தொழிற்துறையில், பேரியம் குளோரைடானது எரிகுளோரின் உலைகளில் உப்புக்கரைசலைத் துாய்மைப்படுத்துவதில் முக்கியமாகப் பயன்படுத்ததப்படுகிறது. மேலும், வெப்பத்தால் பண்படுத்தப்படும் உப்புக்களின் தயாரிப்பு எஃகு வார்ப்புகளை கடினப்படுத்தும் செயல்முறைகள், நிறமிப்பொருட்களின் தயாரிப்பு மற்றும் இதர பேரியம் உப்புக்களின் தயாரிப்பு ஆகியவற்றில் பயன்படுகிறது. BaCl2 பட்டாசுத்தொழிலில் பிரகாசமான பச்சை நிறத்தைத் தருவதற்கு பயன்படுகிறது. இதன் நச்சுத்தன்மையின் காரணமாக பயன்பாடுகளின் அளவானது ஒரு எல்லைக்குட்பட்டதாக அமைகிறது. பாதுகாப்புபேரியம் குளோரைடு, இதர நீரில் கரையக்கூடிய பேரியம் உப்புக்களுடன் சேர்த்து மிகுந்த நச்சுத்தன்மை உள்ளதாகும்.[10] சோடியம் சல்பேட்டு மற்றும் மக்னீசியம் சல்பேட்டு ஆகியவை பேரியம் குளோரைடுடன் வினைபுரிந்து நீரில் கரையாத பேரியம் சல்பேட்டைத் (BaSO4) தருவதாலும், அத்தகைய பேரியம் சல்பேட்டு தனது கரையாத தன்மையால் ஒப்பீட்டு நிலையில் குறைவான நச்சுத்தன்மையற்றதாக உள்ளதாலும், மிகச்சிறந்த எதிர் மருந்துகளாக உள்ளன. மேற்கோள்கள்
வெளி இணைப்புகள்
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia