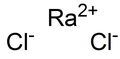ரேடியம் குளோரைடு
ரேடியம் குளோரைடு (Radium chloride) RaCl2 என்ற மூலக்கூறு வாய்பாடுடன் கூடிய ரேடியம் மற்றும் குளோரின் கலந்த கனிமச் சேர்மமாகும். இச்சேர்மமே முதன் முதலில் தூயநிலையில் தனிமைப்படுத்தப்பட்ட ரேடியம் சேர்மமாகும். பேரியத்தில் இருந்து ரேடியத்தை பிரித்தெடுக்கும் அசல் முறையில் மேரி கியூரி மற்றும் ஆந்திரே – லூயிசு டெபைமே ஆகியோர் ரேடியம் குளோரைடை உபயோகப்படுத்தினர்[3]. ரேடியம் குளோரைடு கரைசலில் பாதரசத்தை எதிர்மின்வாயாக செயல்படவைத்து மின்னாற்பகுப்பு முறையில் முதன்முதலில் ரேடியம் உலோகம் தயார் செய்யப்பட்டது[4]. தயாரிப்புகரைசலில் இருந்து ரேடியம் குளோரைடு இருநீரேறியாக படிகமாக்கப்படுகிறது. இப்படிகங்களை ஆர்கான் முன்னிலையில் 100 பாகை செல்சியசு வெப்பநிலையில் ஒரு மணி நேரமும் அதைத் தொடர்ந்து 5.30 மணி நேர அளவிற்கு 520 பாகை செல்சியசு வெப்பநிலையிலும் சூடாக்குவதன் மூலம் நீர்நீக்கம் செய்யலாம்[5]. ஒருவேளை மற்ற நேர்மின் அயனிகளும் கரைசலில் இருப்பதாக அறிய நேர்ந்தால் நீர்நீக்கமானது ஐதரசன் குளோரைடின் கீழ் இணைப்பு முறையில் செய்து முடிக்கப்படுகிறது[6] . தொடர்ச்சியான உலர் ஐதரசன் குளோரைடு வாயு ஓட்டத்தில் ரேடியம் புரோமடை சூடாக்குவதன் மூலமாகவும் ரேடியம் குளோரைடு தயாரிக்கப்படுகிறது அல்லது ரேடியம் சல்பேட்டை உலர் காற்றில் நீர்நீக்கம் செய்தும் பின்னர் அதிலுள்ள சல்பேட்டை ஐதரசன் குளோரைடு வாயு ஓட்டத்தில் சூடாக்கியும் இதைத் தயாரிக்கலாம்[1]. பண்புகள்ரேடியம் குளோரைடு நிறமற்றதாகவும் வெண்மையான உப்பாகவும் காணப்படுகிறது. குறிப்பாக சூடாக்கும் போது இது நீல பச்சையாக ஒளிர்கிறது. நாட்பட நாட்பட இதன்நிறம் படிப்படியாக மஞ்சள் நிறமாக மாறுகிறது. அதேசமயம் பேரியம் சேர்ந்து மாசடைவதால் இது ரோசா நிறமாக காட்சியளிக்கிறது[1]. மற்ற காரமண் உலோக குளோரைடுகளைவிட இது நீரில் சிறிதளவே கரைகிறது. 25 பாகை செல்சியசு வெப்பநிலையில் இதன் கரைதிறன் 245கி/லி ஆகும். ஆனால் பேரியம் குளோரைடின் கரைதிறன் 307கி/லி ஆகும்[2]. ஐதரோகுளோரிக் அமிலக் கரைசல்கள் என்றால் இவ்வேறுபாடு மேலும் கூடுதலாக காணப்படுகிறது. பகுதி காய்ச்சி வடித்தல் முறையில் பேரியத்திலிருந்து ரேடியம் பிரித்தெடுக்கும் முதல்நிலைகளில் இப்பண்பு உபயோகமாகிறது. கொதிநிலை மாறாத ஐதரோகுளோரிக் அமிலத்தில் மட்டுமே ரேடியம் குளோரைடு அரிதாக கரைகிறது. நடைமுறையில் அடர்த்தியான ஐதரோகுளோரிக் அமிலத்தில் இது கிட்டத்தட்ட கரையாது[7]. வாயு நிலையில் உள்ள ரேடியம் குளோரைடு மற்ற கார உலோக உப்பீனிகள் போல ரேடியம் குளோரைடு மூலக்கூறுகளாக காணப்படுகிறது. கட்புலனாகும் நிறமாலையில் இவ்வாயு 676.3 நாமீ மற்றும் 649.8 நாமீ (சிவப்பு) {[அலைநீளம்|அலைநீள]] வரம்புகளில் நன்றாகப் புலனாகிறது. ரேடியம் – குளோரின் பிணைப்பின் பிணைப்பு பிரிப்பாற்றல் 2.9 எலக்ட்ரான் வோல்டு என்றும் இந்த பிணைப்பின் நீளம் 292 பிக்கோ மீட்டர் என்றும் கணக்கிடப்பட்டுள்ளது[8] and its length as 292 pm.[9]. அபரகாந்தப் பேரியம் குளோரைடுக்கு மாறாக, ரேடியம் குளோரைடு பலவீனமான 1.05 × 106 என்ற எதிர்காந்த ஏற்புத்திறன் கொண்ட இணைகாந்தமாக இருக்கிறது. மேலும், வெளிப்படுத்தும் தீச்சுடரின் நிறத்திலும் இது பேரியம் குளோரைடுடன் மாறுபடுகிறது. பேரியம் குளோரைடு பச்சைநிற சுவாலையையும் ரேடியம் குளோரைடு சிவப்பு நிறசுவாலையையும் வெளிப் படுத்துகின்றன[1]. பயன்கள்இன்றளவிலும் பிட்ச்பிளெண்டெ அல்லது யுரேனைட்டு தாதுவில் இருந்து ரேடியம் பிரித்தெடுக்கும் ஆரம்ப கட்டங்களில் ரேடியம் குளோரைடு பயன்படுத்தப்படுகிறது.சில மில்லிகிராம் ரேடியத்திற்காக டன் கணக்கிலான தாதுப் பொருட்கள் இம்முறையில் செலவழிகிறது. பிரித்தெடுத்தலின் இறுதிக்கட்டங்களில் பயனாகும் ரேடியம் புரோமைடு அல்லது ரேடியம் குரோமேட்டு அடிப்படையில் அமைந்த இச்செயல்முறை மலிவானது என்றாலும் வினைத்திறன் குறைந்தது ஆகும். ரேடான் வாயு தயாரிக்கவும் ரேடியம் குளோரைடு உபயோகமாகிறது. இவ்வாயு புற்றுநோய் சிகிச்சையில் பயன்படுத்தப்படுகிறது ரேடியம்-223 டைகுளோரைடு ஒரு ஆல்பா உமிழும் சேர்மம் என்பதால் கதிரியக்க மருந்தாக்குதல் தொழிலில் பயன்படுகிறது. முன்னிற்குஞ்சுரப்பி புற்றுநோய் எலும்புபுற்றாக இடம் பெயர்வதை தடுக்கும் மருந்தாக இதைப் பயன்படுத்த அமெரிக்க உணவு மற்றும் மருந்து நிர்வாகம் அளிக்கும் ஒப்புதலை 2013 ஆம் ஆண்டு மே மாதத்தில் பேயர் பெற்றார். அறியப்பட்டுள்ள மிக வலிமையான மருந்துகளில் ஒன்றாக ரேடியம் குளோரைடு 223 கருதப்படுகிறது. மேற்கோள்கள்
உசாத்துணை
ஆதாரங்கள்
|
||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia