பொட்டாசியம் அசைடு
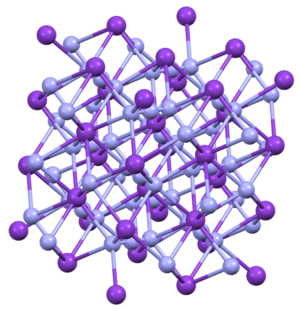
பொட்டாசியம் அசைடு (Potassium azide) என்பது KN3 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு கனிம வேதியல் சேர்மம் ஆகும். வெண்மை நிறத்தில் காணப்படும் இச்சேர்மம் தண்ணீரில் கரைகிறது. ஆய்வுக்கூடங்களில் வினைப்பொருளாகப் பயன்படுத்தப்படுகிறது. மண்ணில் நைட்ரசன் ஏற்றத்தை தடுக்கும் வேதிப்பொருளாக விளங்குகிறது[3]. அமைப்புKN3, RbN3, CsN3, மற்றும் TlN3 ஆகிய சேர்மங்கள் யாவும் ஒரே வகையான நாற்கோண மூலக்கூற்று [4]அமைப்பிலேயே படிகமாகின்றன. அசைடானது நேரெதிரான மறைக்கப்பட்ட திசையமைவுகளில் எட்டு நேர்அயனிகளுடன் பிணைக்கப்பட்டுள்ளது. இந்நேர் அயனிகள் விளிம்புநிலை எட்டு நைட்ரசன் மையங்களுடன் பிணைக்கப்பட்டுள்ளன[5].  தயாரிப்பு மற்றும் வினைகள்பொட்டாசியம் கார்பனேட்டை அவ்விடத்தில்[6] உருவான ஐதரசோயிக் அமிலத்துடன் சேர்த்து வினைப்படுத்துவதால் பொட்டாசியம் அசைடு தயாரிக்கலாம். மாறாக இதனையொத்த சோடியம் அசைடோ விசுலைசெனசு செயல்முறையில் சோடியம் அசைடையும் நைட்ரசு ஆக்சைடையும் சேர்த்து தயாரிக்கப்படுகிறது[7] . சூடுபடுத்தும் போது அல்லது புற ஊதாக்கதிர் கதிர்வீச்சுக்கு உட்படுத்தும் போது பொட்டாசியம் உலோகமாகவும் நைட்ரசன் வாயுவாகவும் சிதைவடைகிறது[8] . கார உலோக அசைடுகள் சிதைவடையும் வெப்ப அளவுகள் வருமாறு: NaN3 (275 °செ), KN3 (355 °செ), RbN3 (395 °செ), CsN3 (390 °செ).[9] தீங்குகள்சோடியம் அசைடு போலவே பொட்டாசியம் அசைடும் நச்சுத்தன்மை மிக்கது ஆகும். இதனுடன் தொடர்புடைய சோடியம் அசைடின் அதிகபட்ச அடர்த்தி ஏற்பு மதிப்பு மில்லியன் பகுதிகளுக்கு 0.07 பகுதிகளாகும். அசைடுகளின் நச்சுத்தன்மை அவற்றின் சைட்டோகுரோம் ஆக்சிடேசு எதிர்ப்பில் இருந்து தோன்றுகின்றன. மேற்கோள்கள்
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia