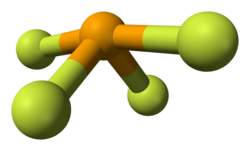
செலீனியம் டெட்ராபுளோரைடு
செலீனியம் டெட்ராபுளோரைடு (Selenium tetrafluoride) (SeF4) ஒரு கனிமச் சேர்மம் ஆகும். இச்சேர்மம் எளிதில் நீருடன் வினைபுரியக்கூடிய நிறமற்ற திரவம் ஆகும். இச்சேர்மமானது கரிமத் தொகுப்பு முறைகளில் (ஆல்ககால்கள், கார்பாக்சிலிக் அமிலங்கள் அல்லது கார்போனைல் ஆகியவற்றின் புளோரினேற்றம்) புளோரினேற்றம் செய்வதற்கான காரணியாகப் பயன்படுத்தப்படுகிறது. மிதமான நிலைகளில் பயன்படுத்தக் கூடிய வாய்ப்பும், வாயுவாக இல்லாமல் திரவ நிலையில் இருப்பதும் இதை கந்தக டெட்ராபுளோரைடைக் காட்டிலும் சிறந்த புளோரினேற்றக் காரணியாக ஆக்குகிறது. தொகுப்பு முறை1907 ஆம் ஆண்டில் பால் லீபியு செலீனியம் மற்றும் புளோரினை வினைவுரியச் செய்ததே இச்சேர்மத்திற்கான முதலில் வெளிவந்த தொகுப்பு முறை ஆகும்.[1]
எளிதில் கையாளக்கூடிய பொருட்களை வைத்து உருவாக்கப்பட்ட தொகுப்பு முறை தயாரிப்பானது செலீனியம் டையாக்சைடினை கந்தக டெட்ராபுளோரைடைக் கொண்டு புளோரினேற்றம் செய்யும் முறையாகும்.[2]
இந்த வினையில் இடைவினைப்பொருளாக செலீனினைல் புளோரைடு (SeOF2) கிடைக்கிறது. இச்சேர்மத்திற்கான மற்றொரு தயாரிப்பு முறை தனிம நிலை செலீனியத்தை குளோரின் டிரைபுளோரைடைடுடன் புளோரினேற்றத்திற்கு உட்படுத்துவதாகும்:
அமைப்பு மற்றும் பிணைப்புசெலீனியம் டெட்ராபுளோரைடில் செலீனியம் +4 ஆக்சிசனேற்ற நிலையைக் கொண்டுள்ளது. வாயு நிலையில் இதன் வடிவம் கந்தக டெட்ராபுளோரைடினை ஒத்த சாய்ந்தாடி அமைப்பினைப் பெற்றுள்ளது. வலுவளவு ஓட்டு இலத்திரன் சோடிகளின் தள்ளுகைக் கொள்கை இதன் அமைப்பை செலீனியம் அணுவைச் சுற்றி 5 இலத்திரன் இணையைக் கொண்ட போலி முக்கோணப் பிரமிடு வடிவம் கொண்டது எனக் கணிக்கிறது. முக்கிய அச்சாக விளங்கக் கூடிய Se-F பிணைப்புகள் 177 F-Se-F பிணைப்புக் கோணமானது 169.2° என்ற அளவிலும் இருக்கிறது. மற்ற இரண்டு புளோரின் அணுக்கள் குறைவான நீளமும்(168 பிக்கோமீட்டர்) 100.6° பினணப்புக் கோணமும் கொண்ட பிணைப்புகளால் இணைக்கப்பட்டுள்ளன. குறைவான செறிவுள்ள கரைசல்களில் இந்த ஒருமத்திற்கான வடிவமைப்பு சிறப்பான நிலையைப் பெற்றிருக்கிறது, ஆனால், உயர் செறிவுகளில், கிடைக்கக் கூடிய ஆதாரங்களின்படி, SeF4 மூலக்கூறுகளுக்கிடையேயான வலிமை குறைந்த இணைப்பின் காரணமாக செலீனியத்தைச் சுற்றிலும் சீர்மை குலைந்த எண்முகி வடிவமைப்பிற்கு வழிவகுக்கிறது. திண்மத்தில் செலீனிய மையமானது ஒரு சீர்மை குலைந்த எண்முகிச் சூழலையே கொண்டுள்ளது. வினைகள்ஐதரசன் புளோரைடில், SeF4 ஆனது கந்தக டெட்ராபுளோரைடைக் (SF4) காட்டிலும் வலிமை குறைந்த காரமாகச் செயல்படுகிறது.(Kb= 2 X 10−2):
SbF5, AsF5, NbF5, TaF5, மற்றும் BF3 ஆகியவற்றுடன் SeF3+ நேரயனிகளைக் கொண்ட அயனி சேர்க்கைப் பொருட்கள் உருவாகின்றன. [3] சீசியம் புளோரைடுடன், (CsF), SeF5− எதிரயனியானது உருவாகிறது. இந்த எதிரயனி குளோரின் பென்டாபுளோரைடு மற்றும் புரோமின் பென்டாபுளோரைடு ஆகியவற்றை ஒத்த சதுர பிரமிடு அமைப்பைப் பெற்றுள்ளது.[4] 1,1,3,3,5,5-எக்சாமெதில்பைப்பெரிடினியம் புளோரைடு அல்லது 1,2-டைமெதில்புரொப்பைல்மும்மெதில்அம்மோனியம்புளோரைடுடன், SeF62− எதிரயனியானது உருவாகிறது. இந்த எதிரயனியானது சீர்குலைந்த எண்முகி வடிவத்தைக் கொண்டுள்ளது. இதன் ஒத்த சேர்மமான SeCl62− (ஒழுங்கு அறுகோண வடிவம்) இலிருந்து இந்த எதிரயனியானது முரண்பட்டு சீர்மை குலைந்த எண்முகி வடிவத்தைப் பெறுகிறது.[5] மேற்கோள்கள்
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia