இலித்தியம் ஆக்சைடு
இலித்தியம் ஆக்சைடு (Lithium oxide) (Li
துாய்மையான Li
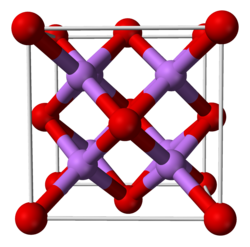
அமைப்புதிண்ம நிலையில் இலித்தியம் ஆக்சைடு ஒரு கால்சியம் புளோரைடு அமைப்பையொத்த ஆண்டிபுளோரைட்டு அமைப்பை ஏற்றுக் கொண்டது. புளோரைடு எதிரயனிகளுக்குப் பதிலாக பதிலியிடப்பட்ட இலித்தியம் நேரயனிகளுடன் புளோரைட்டு அமைப்பும் மற்றும் கால்சியம் நேரயனிகளுக்காக பதிலியிடப்பட்ட ஆக்சைடு எதிரயனிகளையும் கொண்ட அமைப்பாக இருந்தது.[3] தாழ்-ஆற்றல் வாயு நிலை Li வலுவளவு ஓட்டு இலத்திரன் சோடிகளின் தள்ளுகைக் கொள்கையின்படி இச்சேர்மத்திற்கு நீர் மூலக்கூறு கொண்டிருப்பது போன்ற வளைந்த வடிவத்தைக் கொண்டிருப்பதாக கணிக்கப்படுகிறது. பயன்கள்இலித்தியம் ஆக்சைடு சுட்டாங்கல் பளபளப்பாக்கத்தில் இளக்கியாகப் பயன்படுகிறது. இது தாமிரத்துடன் நீல மணிகளையும், கோபால்ட்டுடன் இளஞ்சிவப்பு மணிகளையும் தருகிறது. இலித்தியம் ஆக்சைடு நீர் மற்றும் நீராவியுடன் வினைபுரிந்து இலித்தியம் ஐதராக்சைடினை உருவாக்குகிறது. இவ்வாறு உருவாக்கப்பட்ட இலித்தியம் ஐதராக்சைடு உடனுக்குடன் அக்கலவையிலிருந்து பிரித்தெடுக்கப்பட வேண்டும். வெப்ப தடுப்பு பூச்சு அமைப்புகளுக்குள் அழிவு ஏற்படுத்தாத உமிழ்வு நிறமாலையியல் மதிப்பீடு மற்றும் சிதைவு கண்காணிப்பு ஆகியவற்றிற்காக பயன்படுத்துதல் குறித்தும் இச்சேர்மம் ஆய்விடப்பட்டு வருகிறது. இலித்தியம் ஆக்சைடின் மின்னாற்பகுப்பின் மூலமாகவும் இலித்தியம் உலோகமானது பெறப்படுகிறது. இவ்வினையில் ஆக்சிசன் உபவிளைபொருளாகக் கிடைக்கப்பெறுகிறது. மேலும் காண்க
மேற்கோள்கள்
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia